解答题-工业流程题 适中0.65 引用1 组卷327
氧化铁黄又称羟基铁,简称铁黄,化学式为a-FeOOH,具有良好的耐光性、耐大气性和耐碱性,较其他黄色颜料的遮盖力高,着力也强。广泛地用于橡胶制品、油漆、塑料、油墨、药片糖衣等的着色,也是人造大理石、水磨石地面、铺路砖、墙面粉饰等的着色剂。由生产钛白粉废渣制备铁黄的过程如下。

资料:
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4
I、纯化过程
(1)纯化过程中加入过量铁粉的目的是___________ 。
(2)充分反应后,分离混合物的方法是___________ 。
Ⅱ、制备晶种
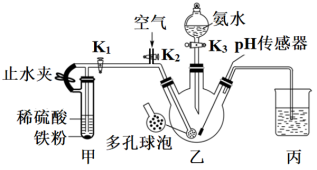
(3)实验室模拟制备晶种的装置如图1所示(部分夹持装置省略),制备FeOOH晶种的过程操作如下:i.关闭 ,打开止水夹与
,打开止水夹与 ;ii.关闭止水夹,一段时间后,打开
;ii.关闭止水夹,一段时间后,打开 ;iii.当乙中
;iii.当乙中 时,关闭
时,关闭 、
、 ,打开
,打开 ,通入空气。溶液中的pH随时间变化如图2所示。
,通入空气。溶液中的pH随时间变化如图2所示。
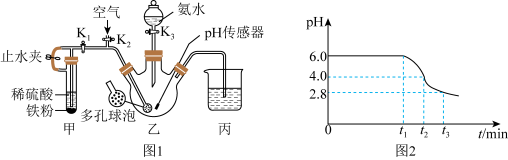
①检查图1中乙的气密性的操作为___________ 。
②通入空气时,多孔球泡的作用为___________ 。
③用NH3·H2O、FeSO4溶液和氧气制备铁黄晶种过程时间比较长,加入亚硝酸钠等可缩短制备时间,经查阅文献发现,NaNO2在反应中起催化剂作用,实际起催化作用的是其与稀H2SO4反应生成的气体。改变不同的实验条件,发现适当的空气流速、合适的pH和温度(40℃)、增加催化剂用量都能够提高产率。温度过高或过低均影响产率的原因是(不考虑副反应)___________ 。
④pH≈4时制得铁黄晶种(如图2所示)。0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:___________ 。
Ⅲ、产品的检验
(4)铁黄产品也可以用Fe2O3•xH2O表示。为了测定所制备铁黄Fe2O3•xH2O中x的值,用分析天平准确称量m1g样品置于坩埚中加热、冷却后称量;经过重复操作,当达到恒重时,残留固体质量为m2g,则x =___________ 。

资料:
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O
I、纯化过程
(1)纯化过程中加入过量铁粉的目的是
(2)充分反应后,分离混合物的方法是
Ⅱ、制备晶种
(3)实验室模拟制备晶种的装置如图1所示(部分夹持装置省略),制备FeOOH晶种的过程操作如下:i.关闭

①检查图1中乙的气密性的操作为
②通入空气时,多孔球泡的作用为
③用NH3·H2O、FeSO4溶液和氧气制备铁黄晶种过程时间比较长,加入亚硝酸钠等可缩短制备时间,经查阅文献发现,NaNO2在反应中起催化剂作用,实际起催化作用的是其与稀H2SO4反应生成的气体。改变不同的实验条件,发现适当的空气流速、合适的pH和温度(40℃)、增加催化剂用量都能够提高产率。温度过高或过低均影响产率的原因是(不考虑副反应)
④pH≈4时制得铁黄晶种(如图2所示)。0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:
Ⅲ、产品的检验
(4)铁黄产品也可以用Fe2O3•xH2O表示。为了测定所制备铁黄Fe2O3•xH2O中x的值,用分析天平准确称量m1g样品置于坩埚中加热、冷却后称量;经过重复操作,当达到恒重时,残留固体质量为m2g,则x =
2022·广东·模拟预测
类题推荐
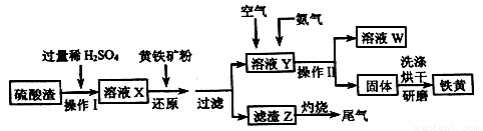
用黄铁矿(主要成分FeS2)还原硫酸渣制备铁黄颜料(主要成分为FeOOH),工业流程如下:
+
c(Fe2+)或c(Fe3+)浓度分别为1mol·L-1,形成对应沉淀的pH范围如下表:
(1)从物质分类的角度,FeOOH属于_______ 。
(2)步骤②被氧化的元素是_______ (填写元素符号)。
(3)制备晶种:为制备高品质铁黄产品,需先制备少量铁黄晶种。实验时,将NaOH按一定计量比加入到FeSO4溶液中,混合溶液的pH随时间变化关系如图所示。搅拌混合均匀,0-15分钟时段,溶液pH明显降低,请用离子方程式解释原因:_______ 。在晶种制备阶段,晶种液未出现红褐色沉淀。pH约为6时,铁元素存在的主要形式为_______ (填写化学符号),此时通入空气,15~80分钟时段,pH基本不变,结合方程式解释原因_______ 。
+
pH为4.5~5时制得铁黄晶种。
(4)二次氧化时,溶液的pH应控制到3~4,过低会造成铁黄质量降低,原因可能是_______ 。
(5)步骤④中检验洗涤是否完全的方法是_______ 。
(6)铁黄的化学式还可以写成Fe2O3·xH2O。为了测定铁黄中结晶水的含量,用分析天平准确称量m1g样品置于坩埚中加热,冷却;经反复操作,当样品恒重时称得质量为m2g,则x=_______ (用含m1、m2的表达式表示)。
+

c(Fe2+)或c(Fe3+)浓度分别为1mol·L-1,形成对应沉淀的pH范围如下表:
| Fe(OH)2 | FeOOH | |
| 开始沉淀的pH | 5.8 | 1.2 |
| 沉淀完全的pH | 8.3 | 2.8 |
(1)从物质分类的角度,FeOOH属于
(2)步骤②被氧化的元素是
(3)制备晶种:为制备高品质铁黄产品,需先制备少量铁黄晶种。实验时,将NaOH按一定计量比加入到FeSO4溶液中,混合溶液的pH随时间变化关系如图所示。搅拌混合均匀,0-15分钟时段,溶液pH明显降低,请用离子方程式解释原因:
+

pH为4.5~5时制得铁黄晶种。
(4)二次氧化时,溶液的pH应控制到3~4,过低会造成铁黄质量降低,原因可能是
(5)步骤④中检验洗涤是否完全的方法是
(6)铁黄的化学式还可以写成Fe2O3·xH2O。为了测定铁黄中结晶水的含量,用分析天平准确称量m1g样品置于坩埚中加热,冷却;经反复操作,当样品恒重时称得质量为m2g,则x=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网