填空题 适中0.65 引用4 组卷1050
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的关键环节。
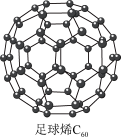
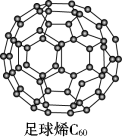
I.C60可用作储存氢气的材料,结构如下图所示。
(1)继C60后,科学家合成了Si60、N60,三者结构相似。下列说法正确的是_______(填序号)
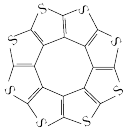
II.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示),每个平面小上下最多可吸附10个H2分子。
(2)C16S8与H2间以_______ (填微粒间作用力类型)结合。
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):_______ 。
III.LiBH4是储氢材料,已知其由Li+和BH 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
(4)锂位于元素周期表的_______ 。
(5)由元素周期律能得到_______。(填序号)。
(6)LiBH4中不存在的作用力有_______(填序号)。
(7)氢化锂(LiH)是离子化合物,写出其电子式_______ ,LiH中负离子半径大于正离子半径,其原因是_______ 。
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为_______ 个。
I.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60,三者结构相似。下列说法正确的是_______(填序号)
| A.C60、Si60、N60都属于共价晶体 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
| C.由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D.由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
II.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示),每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):
III.LiBH4是储氢材料,已知其由Li+和BH
(4)锂位于元素周期表的
(5)由元素周期律能得到_______。(填序号)。
| A.碱性:LiOH<NaOH | B.与水反应的剧烈程度:Li<Na |
| C.溶解度:LiOH<NaOH | D.密度:Li<Na |
| A.离子键 | B.共价键 | C.金属键 | D.分子间作用力 |
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为
21-22高一下·上海杨浦·期中
类题推荐
Ⅰ.下表列出了①~⑨九种元素在周期表中的位置:
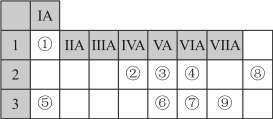
请按要求回答下列问题。
(1)元素④在周期表中所处位置为____________ 。
(2)按气态氢化物的稳定性由弱到强的顺序排列,④⑥⑦的简单氢化物稳定性:________ (写氢化物的化学式)。
(3)元素⑤的最高价氧化物的水化物的电子式为_________ 。
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式:___________________ 。
(5)③的简单氢化物与其最高价氧化物的水化物反应的离子方程式:_________________ 。
Ⅱ.LiBH4是储氢材料,已知其由Li+和 (H为-1价)构成,LiBH4释放氢气的原理为2LiBH4=2LiH+2B+3H2↑。
(H为-1价)构成,LiBH4释放氢气的原理为2LiBH4=2LiH+2B+3H2↑。
(6)由元素周期律能得到_________(填标号,下同)。
(7)LiBH4中不存在的作用力有_________。
(8)氢化锂(LiH)中负离子半径大于正离子半径,其原因是____________________ 。

请按要求回答下列问题。
(1)元素④在周期表中所处位置为
(2)按气态氢化物的稳定性由弱到强的顺序排列,④⑥⑦的简单氢化物稳定性:
(3)元素⑤的最高价氧化物的水化物的电子式为
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式:
(5)③的简单氢化物与其最高价氧化物的水化物反应的离子方程式:
Ⅱ.LiBH4是储氢材料,已知其由Li+和
(6)由元素周期律能得到_________(填标号,下同)。
| A.碱性:LiOH<NaOH | B.与水反应的剧烈程度:Li<Na |
| C.溶解度:LiOH<NaOH | D.密度:Li<Na |
(7)LiBH4中不存在的作用力有_________。
| A.离子键 | B.极性共价键 |
| C.非极性共价键 | D.分子间作用力 |
(8)氢化锂(LiH)中负离子半径大于正离子半径,其原因是
能源材料已成为当今科学研究的热点。请回答下列问题:
(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示,某同学推断A的核外电子排布为:1s22s22p63s13p1,该电子排布式违背了__ ;若该原子核外电子确有三层,则该元素位于周期表__ 族,写出A燃烧后形成的氧化物的电子式:__ 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是__ (填序号)。
a.C60、Si60、N60都属于新型化合物
b.C60、Si60、N60互为同分异构体
c.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d.已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
(3)超导材料在节能、储能方面的应用。如图是超导材料元素在周期表中的分布,其中短周期元素中原子半径最大的是__ (填元素符号),其原子最外层有__ 种运动状态不同的电子,写出其最高价氧化物对应水化物的电离方程式:__ 。

(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示,某同学推断A的核外电子排布为:1s22s22p63s13p1,该电子排布式违背了
| I1 | I2 | I3 | I4 | …… | |
| 电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | …… |
a.C60、Si60、N60都属于新型化合物
b.C60、Si60、N60互为同分异构体
c.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d.已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
(3)超导材料在节能、储能方面的应用。如图是超导材料元素在周期表中的分布,其中短周期元素中原子半径最大的是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网