解答题-原理综合题 较难0.4 引用1 组卷84
回答下列问题:
I.页岩气的主要成分为 ,还含有少量的
,还含有少量的 等气体,工业上可采用下列方法除去其中的
等气体,工业上可采用下列方法除去其中的 。
。
(1) 和
和 重整可制得合成气(CO、
重整可制得合成气(CO、 )。已知下列热化学反应方程式:
)。已知下列热化学反应方程式:
 ;
;
 ;
;
 ;
;
反应 的
的
___________  。
。
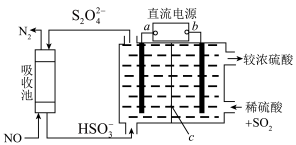
(2)利用电解转化法从烟气中分离 的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:
的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:___________ 。
Ⅱ. 是实验室中常用试剂,也是工业原料。
是实验室中常用试剂,也是工业原料。
(3)工业上常用纯碱法富集从海水中提取的溴。第一步,用纯碱溶液吸收空气吹出的溴蒸气,生成NaBr和 ,第二步,向吸收液中加入稀硫酸生成
,第二步,向吸收液中加入稀硫酸生成 。第二步的离子方程式为
。第二步的离子方程式为___________ 。
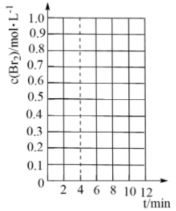
(4)利用溴化铜制备溴: 。在密闭容器中加入足量的
。在密闭容器中加入足量的 固体,发生上述反应。在温度为T℃时达到平衡,测得
固体,发生上述反应。在温度为T℃时达到平衡,测得 。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。
。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。
①在下图所示的坐标系中补充4min~10min之间 关系曲线
关系曲线___________ 。
②下列固体物质的物理量不变时,能表示该反应已达到平衡状态的是___________ (填字母)。
a.总质量 b.总物质的量 c.平均摩尔质量
(5)已知:拟卤素,如 、
、 等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
①由此推知, 、
、 、
、 的氧化性强弱排序为
的氧化性强弱排序为___________ 。写出B试管中发生反应的离子方程式:___________ 。
②向含淀粉的KI溶液中滴加 溶液,可观察到现象是
溶液,可观察到现象是___________ 。
(6)T℃时,HBr(g)催化氧化反应为 。在体积为VL的恒容密闭容器中充入4molHBr(g)和
。在体积为VL的恒容密闭容器中充入4molHBr(g)和 ,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=
,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=___________ 。
I.页岩气的主要成分为
(1)
反应
(2)利用电解转化法从烟气中分离

Ⅱ.
(3)工业上常用纯碱法富集从海水中提取的溴。第一步,用纯碱溶液吸收空气吹出的溴蒸气,生成NaBr和
(4)利用溴化铜制备溴:
①在下图所示的坐标系中补充4min~10min之间

②下列固体物质的物理量不变时,能表示该反应已达到平衡状态的是
a.总质量 b.总物质的量 c.平均摩尔质量
(5)已知:拟卤素,如
①由此推知,
②向含淀粉的KI溶液中滴加
(6)T℃时,HBr(g)催化氧化反应为
21-22高二下·江苏·期中
类题推荐
煤的气化和天然气净化过程中会产生H2S,将其吸收与转化是环境保护和资源利用的有效措施。回答下列问题:
(1)利用足量纯碱溶液可吸收低浓度H2S,生成的含硫物质主要是___________ (填化学式。H2S的 ,
, ;H2CO3的
;H2CO3的 ,
, )。
)。
(2)电解氧化法处理H2S的原理是:在氧化反应器中,利用Fe3+氧化H2S;在电解反应器中实现Fe3+的再生,并副产氢气,总反应为
 ,相关物质的燃烧热数据如下表:则
,相关物质的燃烧热数据如下表:则 H=
H=___________ kJ mol-1。
mol-1。
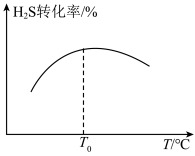
(3)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离出H2.在恒容密闭容器中,以H2S的起始浓度均为0.009mol/L控制不同温度进行H2S分解: ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。___________ (填“吸热”或“放热”)反应,985℃时该反应在tmin时达到平衡,则从开始到平衡的平均反应速率为___________ 。
②随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是___________ 。
③若在一容积可变容器中充入1molH2S进行上述反应,平衡转化率为20%,维持温度和压强不变,欲将H2S的平衡转化率提升至50%,需向反应器中充入___________ molAr作为稀释气。
(4)工业上采用C6H5Cl和H2S的高温气相反应制备有机合成中间体苯硫酚(C6H5SH),同时有副产物C6H6生成:
I.

Ⅱ.
使氯苯和硫化氢按一定的比例进入反应器,定时测定由反应器尾端出来的混合气中各产物的量,得到单程收率(原料一次性通过反应器反应后得到的产品与原料总投入量的百分比)与温度的关系如图所示。___________ (填“I”或“Ⅱ”)。根据图中曲线判断,下列说法正确的是___________ (填标号)。
A.500℃~540℃反应1已经达到平衡
B.590℃以上,随温度升高,反应1平衡逆向移动
C.590℃以上,随温度升高,反应I消耗H2S减少
D.645℃,反应I、Ⅱ速率相等
(1)利用足量纯碱溶液可吸收低浓度H2S,生成的含硫物质主要是
(2)电解氧化法处理H2S的原理是:在氧化反应器中,利用Fe3+氧化H2S;在电解反应器中实现Fe3+的再生,并副产氢气,总反应为
| 物质 | H2S(g) | S(s) | H2(g) |
| 燃烧热 | -562.0 | -296.8 | -285.8 |
(3)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离出H2.在恒容密闭容器中,以H2S的起始浓度均为0.009mol/L控制不同温度进行H2S分解:
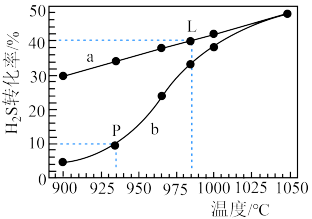
②随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是
③若在一容积可变容器中充入1molH2S进行上述反应,平衡转化率为20%,维持温度和压强不变,欲将H2S的平衡转化率提升至50%,需向反应器中充入
(4)工业上采用C6H5Cl和H2S的高温气相反应制备有机合成中间体苯硫酚(C6H5SH),同时有副产物C6H6生成:
I.
Ⅱ.
使氯苯和硫化氢按一定的比例进入反应器,定时测定由反应器尾端出来的混合气中各产物的量,得到单程收率(原料一次性通过反应器反应后得到的产品与原料总投入量的百分比)与温度的关系如图所示。
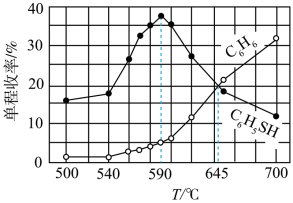
A.500℃~540℃反应1已经达到平衡
B.590℃以上,随温度升高,反应1平衡逆向移动
C.590℃以上,随温度升高,反应I消耗H2S减少
D.645℃,反应I、Ⅱ速率相等
当今世界多国相继规划了碳达峰、碳中和的时间节点,中国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低。2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。因此,降低空气中二氧化碳含量成为研究热点,其中研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和解决能源问题的方案之一、
Ⅰ.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。
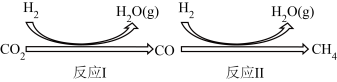
已知:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔHl=-205kJ∙mol-1
反应Ⅱ:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH2=-246kJ∙mol-1
(1)则反应Ⅰ的热化学方程式为___________ 。
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应Ⅰ和反应Ⅱ;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率
___________ ,CH4的体积分数=___________ 。
Ⅱ.在催化剂作用下CO2加氢还可制得甲醇。
(3)能说明反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=+50kJ∙mol-1已达平衡状态的是___________(填字母)。
Ⅲ.催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH<0;
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0。
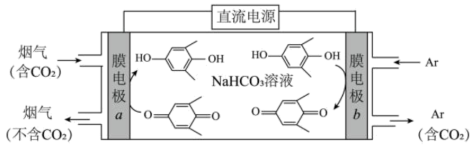
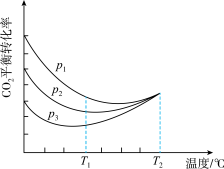
(4)向密闭容器中以物质的量之比为1∶3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为___________ ;T2℃时主要发生反应________ (填“①”或“②”)。
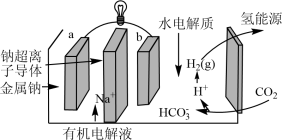
(5)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。系统工作时,a极为________ 极,b极区的电极反应式为___________ 。
Ⅰ.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。

已知:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔHl=-205kJ∙mol-1
反应Ⅱ:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH2=-246kJ∙mol-1
(1)则反应Ⅰ的热化学方程式为
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应Ⅰ和反应Ⅱ;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率
Ⅱ.在催化剂作用下CO2加氢还可制得甲醇。
(3)能说明反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=+50kJ∙mol-1已达平衡状态的是___________(填字母)。
| A.单位时间内生成1molCH3OH(g)的同时消耗了3molH2(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |
Ⅲ.催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH<0;
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0。
(4)向密闭容器中以物质的量之比为1∶3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为

(5)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。系统工作时,a极为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网