填空题 适中0.65 引用1 组卷278
能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题。回答下列问题:
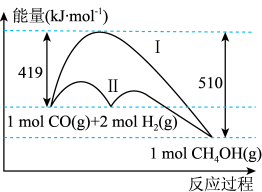
(1)工业上用CO生产燃料甲醇,一定条件下发生反应: ,反应过程中的能量变化情况如图所示。曲线
,反应过程中的能量变化情况如图所示。曲线_______ (选填“Ⅰ”或“Ⅱ”)表示使用催化剂的反应过程。计算当反应生成 时,能量变化值是
时,能量变化值是_______ kJ。
(2)用 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有 个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为
个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为_______ 。
(3)已知拆开 键、
键、 键、
键、 键分别需要的能量是436kJ、391kJ、946kJ,则
键分别需要的能量是436kJ、391kJ、946kJ,则 与
与 反应生成
反应生成 需放出的热量为
需放出的热量为_______ kJ。
(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用 生产甲醇燃料的方法:
生产甲醇燃料的方法:
已知:①

②

③

④

则表示 燃烧生成
燃烧生成 气体和液态水的反应热
气体和液态水的反应热 为
为_______  (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
(5)已知乙醇的燃烧热为 。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是
。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是_______  。(取小数点后一位)
。(取小数点后一位)
(1)工业上用CO生产燃料甲醇,一定条件下发生反应:

(2)用
(3)已知拆开
(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用
已知:①
②
③
④
则表示
(5)已知乙醇的燃烧热为
21-22高一下·陕西西安·期中
类题推荐
回答下列问题:
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
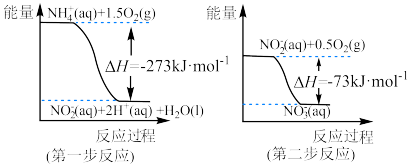
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1mol 全部氧化成
全部氧化成 的热化学方程式是
的热化学方程式是___________ 。
(2)已知:

 ①
①

 ②
②
则 与
与 反应放出509kJ热量时,电子转移数目为
反应放出509kJ热量时,电子转移数目为___________ 。
(3)已知
 ,蒸发1mol
,蒸发1mol 需要吸收的能量为30kJ,其他相关数据如下表:
需要吸收的能量为30kJ,其他相关数据如下表:
则表中 =
=___________ 。
(4)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:

途径Ⅱ:




 (
( 、
、 、
、 、
、 均为正值)
均为正值)
按途径Ⅱ反应,1mol 完全燃烧时放出的热量为
完全燃烧时放出的热量为___________ kJ(用含 、
、 、
、 的代数式表示),等量的丙烷通过两种途径完全燃烧时,途径Ⅰ放出的热量
的代数式表示),等量的丙烷通过两种途径完全燃烧时,途径Ⅰ放出的热量___________ (填“大于”、“小于”或“等于”)途径Ⅱ放出的热量。
(5)直接排放含 的烟气会形成酸雨,危害环境。工业上常用催化还原法和碱吸收法处理
的烟气会形成酸雨,危害环境。工业上常用催化还原法和碱吸收法处理 气体。1mol
气体。1mol 完全燃烧生成气态水和1mol
完全燃烧生成气态水和1mol 燃烧的能量变化如下图所示:
燃烧的能量变化如下图所示:
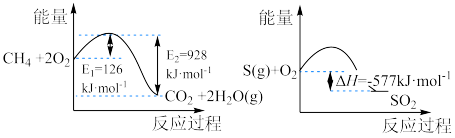
在催化剂作用下, 可以还原
可以还原 生成单质
生成单质 、
、 和
和 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:___________
(6)已知25℃、101kpa时,一些物质的燃烧热为:
完成 和
和 生成
生成 的热化学方程式
的热化学方程式___________ 。
(7)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用 生产甲醇燃料的方法:
生产甲醇燃料的方法:
已知:①

②

③

④

则表示 摩尔燃烧焓的热化学方程式为
摩尔燃烧焓的热化学方程式为___________
(1)在微生物作用的条件下,

①第一步反应是
②1mol
(2)已知:
则
(3)已知
| 物质 | |||
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 |
(4)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:
途径Ⅱ:
按途径Ⅱ反应,1mol
(5)直接排放含
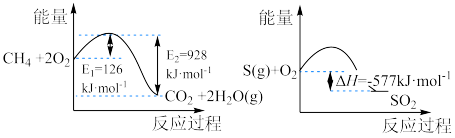
在催化剂作用下,
(6)已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 | |||
| -283.0 | -285.8 | -726.5 |
(7)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用
已知:①
②
③
④
则表示
能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题。回答下列问题:
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是_______ (填字母)。
A、氢能 B、天然气 C、石油
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。反应的活化能为_______ kJ/mol,曲线_______ (选填“I”或“II”)表示使用催化剂的反应过程。计算当反应生成1.5molCH3OH(g)时,能量变化值是_______ kJ。
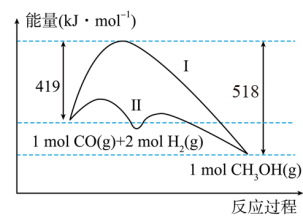
又知该反应中某些物质分子里的化学键的键能数据如下表:
若CO中的C与O之间为三键连接,则C≡O键的键能为_______ kJ·mol-l。
(3)CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。CO2催化加氢合成二甲醚的过程中主要发生下列反应:
反应I:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H=+41.2kJ/mol
反应II:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H=-122.5kJ/mol
其中,反应II:分以下①②两步完成,请写出反应①的热化学方程式。
①_______ 。
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是
A、氢能 B、天然气 C、石油
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。反应的活化能为

又知该反应中某些物质分子里的化学键的键能数据如下表:
化学键 | C-H | H-H | C-O | H-O |
| 键能(kJ∙mol-1) | 413 | 436 | 343 | 465 |
若CO中的C与O之间为三键连接,则C≡O键的键能为
(3)CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。CO2催化加氢合成二甲醚的过程中主要发生下列反应:
反应I:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H=+41.2kJ/mol
反应II:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H=-122.5kJ/mol
其中,反应II:分以下①②两步完成,请写出反应①的热化学方程式。
①
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
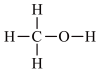
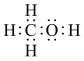 、结构式:
、结构式: