解答题-实验探究题 适中0.65 引用1 组卷237
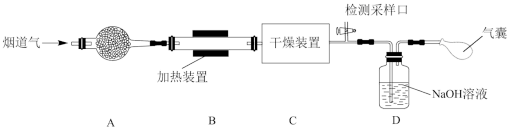
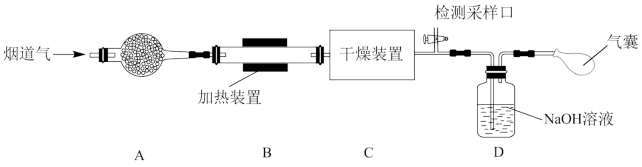
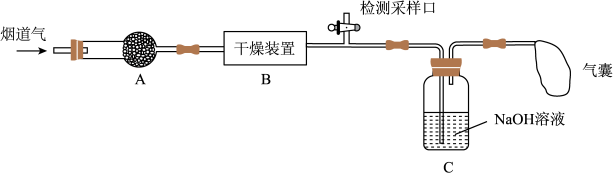
研究性学习小组对某工厂排出的烟道气(主要成分为NO、NO2、N2、粉尘和少量水蒸气)进行处理,实验装置如图:
已知:NO、NO2能与NaOH溶液发生如下反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+ NaNO3+H2O;但NO不能单独与NaOH溶液反应。
(1)实验时在装置A的干燥管中放置一团棉花,吸收粉尘。装置B的干燥装置中应盛放的试剂为____ (填字母)。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4•5H2O)
(2)气体在被装置C中的NaOH溶液吸收前,需在检测采样口测定气体中NO和NO2的含量。为确保NO和NO2气体能够被NaOH溶液完全吸收,则需控制参加反应的NO和NO2物质的量比值为____ (填字母)。
a.≥1 b.=1 c.≤1
(3)若进入装置C的气体中NO和NO2物质的量比值不符合(2)中要求,则气囊中除含有N2外,可能含有少量NO气体。甲同学设计了喷淋吸收塔装置(如图所示),用NaClO溶液来进一步处理NO气体。
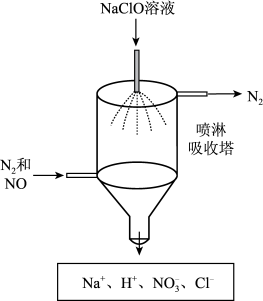
①NaClO溶液吸收NO时发生反应的离子方程式为____ 。
②该装置的优点是____ 。
(4)装置C的吸收液中NO 、NO
、NO 直接排放也会造成水体污染。乙同学设计了以下实验将溶液中
直接排放也会造成水体污染。乙同学设计了以下实验将溶液中 、NO
、NO 转化为N2,实现氮的脱除,具体步骤如下:
转化为N2,实现氮的脱除,具体步骤如下:
①向装置C的吸收液中加入适量H2O2溶液,充分反应后,蒸发浓缩,得到c(NO )为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO
)为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO 氧化为NO
氧化为NO 的离子方程式:
的离子方程式:____ 。
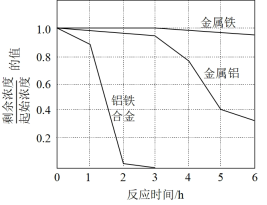
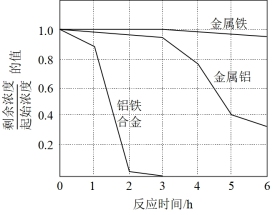
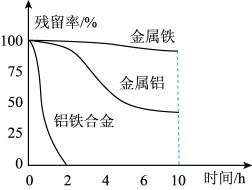
②量取三份50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中将溶液甲中的NO 还原为N2,从而实现脱氮,溶液中NO
还原为N2,从而实现脱氮,溶液中NO 的残留率(残留率=
的残留率(残留率= ×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是____ 。

已知:NO、NO2能与NaOH溶液发生如下反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+ NaNO3+H2O;但NO不能单独与NaOH溶液反应。
(1)实验时在装置A的干燥管中放置一团棉花,吸收粉尘。装置B的干燥装置中应盛放的试剂为
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4•5H2O)
(2)气体在被装置C中的NaOH溶液吸收前,需在检测采样口测定气体中NO和NO2的含量。为确保NO和NO2气体能够被NaOH溶液完全吸收,则需控制参加反应的NO和NO2物质的量比值为
a.≥1 b.=1 c.≤1
(3)若进入装置C的气体中NO和NO2物质的量比值不符合(2)中要求,则气囊中除含有N2外,可能含有少量NO气体。甲同学设计了喷淋吸收塔装置(如图所示),用NaClO溶液来进一步处理NO气体。

①NaClO溶液吸收NO时发生反应的离子方程式为
②该装置的优点是
(4)装置C的吸收液中NO
①向装置C的吸收液中加入适量H2O2溶液,充分反应后,蒸发浓缩,得到c(NO
②量取三份50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中将溶液甲中的NO

21-22高一下·江苏常州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网