解答题-实验探究题 较难0.4 引用3 组卷740
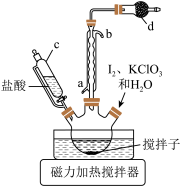
某化学兴趣小组利用如图1所示装置(加持装置省略)制备 。已知
。已知 是一种易溶于水,不溶于酒精的白色或微红色晶体。
是一种易溶于水,不溶于酒精的白色或微红色晶体。
(1)检验如图1装置气密性的方法是___________ ,装置Ⅱ中发生反应的方程式:___________ 。
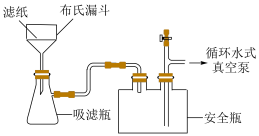
(2)抽滤如图2所示,与用普通漏斗过滤相比,抽滤的优点是___________ ;其最佳操作顺序是___________ ,确认抽干(填标号)。
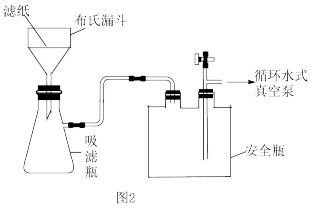
a.打开循环水式真空泵 b.加入少量蒸馏水润湿滤纸 c.转移固液混合物
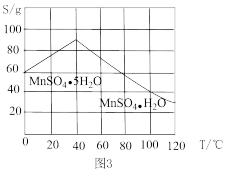
(3)根据图3,加热反应后的溶液并控制温度大于40℃,经蒸发结晶,___________ ,用___________ 洗涤,干燥,可得到产品。
(4)图1装置还存在安全隐患,在Ⅱ后的方框内增加合适的装置和药品以消除这种隐患,在方框内完成作答___________ 。
(5) 产品的纯度可用配位滴定法测定。
产品的纯度可用配位滴定法测定。 被空气氧化成
被空气氧化成 后,可与配位剂三乙醇胺生成
后,可与配位剂三乙醇胺生成 绿色配合物以掩蔽其他离子,再加入盐酸羟胺将
绿色配合物以掩蔽其他离子,再加入盐酸羟胺将 配合物中的
配合物中的 还原成
还原成 ,以K-B为指示剂,用EDTA(可以表示为
,以K-B为指示剂,用EDTA(可以表示为 )标准滴定液进行滴定,反应为:
)标准滴定液进行滴定,反应为: 。准确称取一定质量的
。准确称取一定质量的 晶体加入250mL的锥形瓶中,加20mL水、10mL三乙醇胺,充分振荡,再加入10mL足量的盐酸羟胺。滴入2~3滴K-B作指示剂后溶液呈酒红色,摇匀。用已标定的
晶体加入250mL的锥形瓶中,加20mL水、10mL三乙醇胺,充分振荡,再加入10mL足量的盐酸羟胺。滴入2~3滴K-B作指示剂后溶液呈酒红色,摇匀。用已标定的 溶液滴定,当溶液由酒红色变成纯蓝色,即为终点。实验数据见下表:
溶液滴定,当溶液由酒红色变成纯蓝色,即为终点。实验数据见下表:
则 产品的纯度为
产品的纯度为___________ %(保留整数)。
(1)检验如图1装置气密性的方法是

(2)抽滤如图2所示,与用普通漏斗过滤相比,抽滤的优点是

a.打开循环水式真空泵 b.加入少量蒸馏水润湿滤纸 c.转移固液混合物
(3)根据图3,加热反应后的溶液并控制温度大于40℃,经蒸发结晶,

(4)图1装置还存在安全隐患,在Ⅱ后的方框内增加合适的装置和药品以消除这种隐患,在方框内完成作答
(5)
| 实验 | 起始滴定管读数/mL | 终点滴定管读数/mL | |
| 1 | 0.0845 | 0.20 | 26.60 |
| 2 | 0.0845 | 0.00 | 26.20 |
| 3 | 0.0845 | 0.32 | 28.35 |
2022·山东枣庄·二模
类题推荐
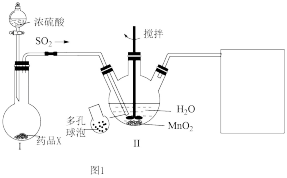
己二酸[ ]是重要的有机合成中间体,是重要的化工原料。实验室利用图1装置(夹持、加热装置省略)制备己二酸。
]是重要的有机合成中间体,是重要的化工原料。实验室利用图1装置(夹持、加热装置省略)制备己二酸。
已知:己二酸的物理常数如下表所示。
Ⅰ.制备:向三颈烧瓶中,先加入一定量的浓 ,再通过仪器M向三颈烧瓶中缓缓加入环己醇,保持80℃持续反应2h。
,再通过仪器M向三颈烧瓶中缓缓加入环己醇,保持80℃持续反应2h。
Ⅱ.提纯:冷却后,抽滤、洗涤、干燥得己二酸粗品。
Ⅲ.测定粗品纯度:精确称取粗品0.0146 g于锥形瓶中,加入适量蒸馏水溶解,加入合适指示剂,用0.01 mol/L的NaOH标准液滴定至终点,重复上述操作三次,平均消耗NaOH标准液的体积为V mL。
实验原理:
 (未配平)。
(未配平)。
回答下列问题:
(1)与分液漏斗相比,仪器M的优点为___________ ;仪器X的作用为___________ 。
(2)制备时,如图1连接装置后需先进行的操作为___________ ;为避免制备过程中尾气污染空气,仪器X后需连接尾气处理装置,其中装置内盛放的试剂为___________ (填化学式)溶液。
(3)洗涤时应选用___________ (填选项字母)。
a.热水 b.冰水 c.乙醇
(4)第一次滴定开始和结束时,滴定管中的液面如图2,则消耗NaOH溶液的体积为___________ mL。
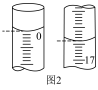
重复上述操作三次,记录另两次数据如表中所示:
最终所得己二酸粗品的纯度为___________ 。

已知:己二酸的物理常数如下表所示。
| 色态 | 相对分子质量 | 熔点/℃ | 溶解性 | ||||
| 己二酸 | 白色晶体 | 146 | 152 | g/100 mL水 | 乙醇 | ||
| 15℃ | 25℃ | 100℃ | 易溶 | ||||
| 1.4 | 2.3 | 160 | |||||
Ⅱ.提纯:冷却后,抽滤、洗涤、干燥得己二酸粗品。
Ⅲ.测定粗品纯度:精确称取粗品0.0146 g于锥形瓶中,加入适量蒸馏水溶解,加入合适指示剂,用0.01 mol/L的NaOH标准液滴定至终点,重复上述操作三次,平均消耗NaOH标准液的体积为V mL。
实验原理:

回答下列问题:
(1)与分液漏斗相比,仪器M的优点为
(2)制备时,如图1连接装置后需先进行的操作为
(3)洗涤时应选用
a.热水 b.冰水 c.乙醇
(4)第一次滴定开始和结束时,滴定管中的液面如图2,则消耗NaOH溶液的体积为

重复上述操作三次,记录另两次数据如表中所示:
| 滴定次数 | 初读数/mL | 末读数/mL |
| 第二次 | 1.20 | 17.60 |
| 第三次 | 5.10 | 23.40 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网