解答题-原理综合题 较难0.4 引用1 组卷259
合成氨的反应对人类解决粮食问题贡献巨大,德国化学家F.Haber因合成氨而获得诺贝尔奖。合成氨反应热化学方程式如下:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
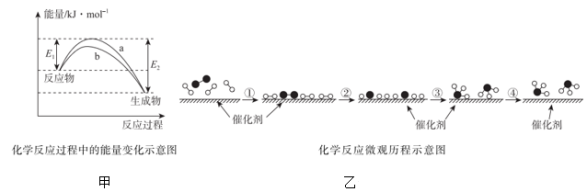
(1)已知N2(g)+3H2(g) 2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为
2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为_______ kJ/mol。
(2)已知N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
H2的燃烧热△H=-285.8kJ/mol
则NH3(g)+ O2(g)=NO(g)+
O2(g)=NO(g)+ H2O(l) △H=
H2O(l) △H=_______ kJ/mol。
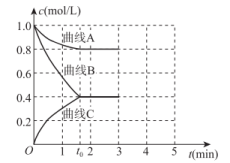
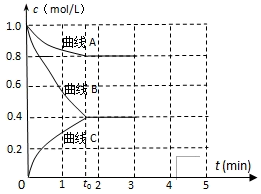
(3)一定温度下,向恒容的密闭容器中充入一定量的N2和H2发生反应,测得各组分浓度随时间变化如图所示。
①表示c(H2)变化的曲线是_______ (填“曲线A”“曲线B”或“曲线C”)。
②0~t0时用NH3表示的化学反应速率为v(NH3)=_______ mol·L-1·min-1。
③下列能说明该反应达到平衡状态的是_______ (填标号)。
A.容器中混合气体的密度不随时间变化
B.容器中的n(N2)与n(H2)的比值不随时间变化
C.断裂3molH-H的同时断裂6molN-H键
D.3v正(H2)=2v逆(NH3)
(4)合成氨反应在某催化剂条件下的相对能量-反应历程如图所示(ad为吸附态):
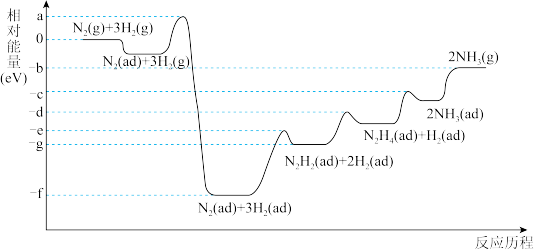
①该过程中含氮的中间产物有_______ 种(填数字)。
②活化能最大的那一步基元反应方程式为_______ 。
③下列说法正确的是_______ (填标号)。
A.最后一步NH3(ad)变为NH3(g)为吸热过程。
B.催化剂参与反应,但不改变合成氨反应的△H
C.催化剂和升温都能降低反应的活化能,加快合成氨的反应速率
D.使用催化剂和压缩容器体积加压都能增大活化分子百分数,加快合成氨反应速率
(1)已知N2(g)+3H2(g)
(2)已知N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
H2的燃烧热△H=-285.8kJ/mol
则NH3(g)+
(3)一定温度下,向恒容的密闭容器中充入一定量的N2和H2发生反应,测得各组分浓度随时间变化如图所示。

①表示c(H2)变化的曲线是
②0~t0时用NH3表示的化学反应速率为v(NH3)=
③下列能说明该反应达到平衡状态的是
A.容器中混合气体的密度不随时间变化
B.容器中的n(N2)与n(H2)的比值不随时间变化
C.断裂3molH-H的同时断裂6molN-H键
D.3v正(H2)=2v逆(NH3)
(4)合成氨反应在某催化剂条件下的相对能量-反应历程如图所示(ad为吸附态):

①该过程中含氮的中间产物有
②活化能最大的那一步基元反应方程式为
③下列说法正确的是
A.最后一步NH3(ad)变为NH3(g)为吸热过程。
B.催化剂参与反应,但不改变合成氨反应的△H
C.催化剂和升温都能降低反应的活化能,加快合成氨的反应速率
D.使用催化剂和压缩容器体积加压都能增大活化分子百分数,加快合成氨反应速率
21-22高一下·湖北武汉·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


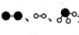 分别表示N2、H2、NH3。
分别表示N2、H2、NH3。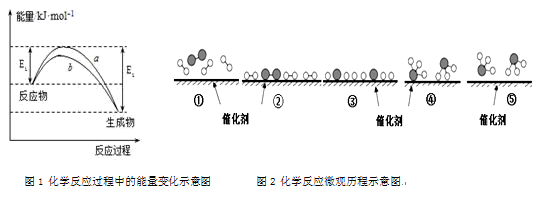
 、
、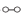 、
、 分别表示N2、H2、NH3。
分别表示N2、H2、NH3。