解答题-实验探究题 适中0.65 引用9 组卷1428
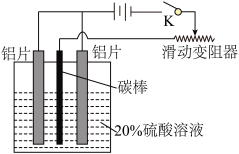
铝的阳极氧化是一种重要的表面处理技术,其原理是用电化学方法处理铝件表面,优化氧化膜结构,增强铝件的抗腐蚀性,同时便于表面着色。取铝片模拟该实验,并测定氧化膜厚度,操作步骤如下:
(1)铝片预处理
铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,离子方程式为:_______ ;再用10%(质量分数)的HNO3溶液对铝片表面进行化学抛光。若取一定体积68%(质量分数)的浓硝酸配制该化学抛光液,需要用到的玻璃仪器有_______ 、_______ 、玻璃棒和胶头滴管。
(2)电解氧化
取预处理过的铝片和铅做电极,控制电流恒定为0.06A,用直流电源在5~6mol/L硫酸中电解。其中铝片接电源_______ 极,产生氧化膜的电极反应式为_______ ,氧化膜的生长过程可大致分为A、B、C三个阶段(如图所示),C阶段多孔层产生孔隙的离子反应方程式为_____ ,A阶段电压逐渐增大的原因是_____ 。
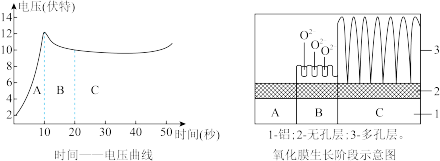
(3)氧化膜质量检验
取出阳极氧化并封闭处理过的铝片,洗净、干燥,在铝片表面滴一滴氧化膜质量检查液(3gK2Cr2O7+75mL水+25mL浓硫酸),用秒表测定表面颜色变为绿色(产生Cr3+)所需时间,可判断氧化膜的耐腐蚀性。写出该变色反应的离子方程式:_______ 。
(4)氧化膜厚度测定
①取氧化完毕的铝片,测得表面积为4.0cm2,洗净吹干,称得质量为0.7654g;
②将铝片浸于60℃的溶膜液中煮沸10分钟进行溶膜处理;
③取出铝片,洗净吹干,称得除膜后铝片质量为0.7442g。
已知氧化膜的密度为2.7g/cm3,可以计算得出氧化膜厚度为_______ μm(1μm=1×10-4cm)。
(1)铝片预处理
铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,离子方程式为:
(2)电解氧化
取预处理过的铝片和铅做电极,控制电流恒定为0.06A,用直流电源在5~6mol/L硫酸中电解。其中铝片接电源

(3)氧化膜质量检验
取出阳极氧化并封闭处理过的铝片,洗净、干燥,在铝片表面滴一滴氧化膜质量检查液(3gK2Cr2O7+75mL水+25mL浓硫酸),用秒表测定表面颜色变为绿色(产生Cr3+)所需时间,可判断氧化膜的耐腐蚀性。写出该变色反应的离子方程式:
(4)氧化膜厚度测定
①取氧化完毕的铝片,测得表面积为4.0cm2,洗净吹干,称得质量为0.7654g;
②将铝片浸于60℃的溶膜液中煮沸10分钟进行溶膜处理;
③取出铝片,洗净吹干,称得除膜后铝片质量为0.7442g。
已知氧化膜的密度为2.7g/cm3,可以计算得出氧化膜厚度为
2022·四川德阳·三模
类题推荐
三氯氧磷(POCl3)可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3,2PCl3+O2=2POCl3。
已知:PCl3、POCl3的部分性质如下:
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置和加热装置已略去):
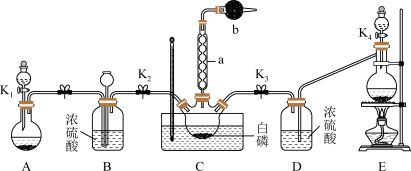
(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器a的名称为_______ ,b中盛放的药品是_______ 。
(2)装置E反应的离子方程式为_______ 。
(3)C反应温度控制在60~65℃,不能过高或过低的原因是_______ 。分离提纯获得POCl3的实验方法是_______ 。
(4)通过测定三氯氧磷产品中氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取ag产品置于盛50.00mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00mL溶液,预处理排除含磷粒子的影响。
②取10.00mL溶液于锥形瓶中,向其中加入Comol/L-1的AgNO3溶液V0mL,使Cl-完全沉淀,再加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3),指示剂,用c1mol/L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为V1mL。
[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12]
滴定终点的现象:_______ 。实验过程中加入硝基苯的目的是_______ ,若无此操作,则所测POCI3的含量将_______ (填“偏高”“偏低”或“不变”)。
(5)产品中POCl3的质量分数为_______ 。
已知:PCl3、POCl3的部分性质如下:
| 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 | |
| PCl3 | -112 | 75.5 | 137.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 153.5 | 遇水生成H3PO4和HCl |

(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器a的名称为
(2)装置E反应的离子方程式为
(3)C反应温度控制在60~65℃,不能过高或过低的原因是
(4)通过测定三氯氧磷产品中氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取ag产品置于盛50.00mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00mL溶液,预处理排除含磷粒子的影响。
②取10.00mL溶液于锥形瓶中,向其中加入Comol/L-1的AgNO3溶液V0mL,使Cl-完全沉淀,再加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3),指示剂,用c1mol/L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为V1mL。
[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12]
滴定终点的现象:
(5)产品中POCl3的质量分数为
三氯氧磷(POCl3)可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化 PCl3 制备 POCl3,反应原理为:P4(白磷)+6Cl2 4PCl3,2PCl3+O2
4PCl3,2PCl3+O2 2POCl3。
2POCl3。
已知:PCl3、POCl3的部分性质如下:
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置和加热装置已略去):
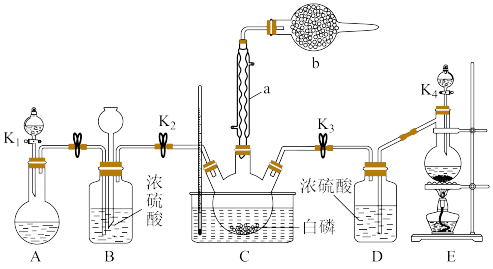
(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为___________ ,B装置的作用是___________ 。
(2)装置 E 反应的离子方程式为___________ 。
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是___________ 。分离提纯获得 POCl3 的实验方法是___________ 。
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:___________ 。实验过程中加入硝基苯覆盖沉淀的目的是___________ ,若无此操作,则所测POCl3的含量将___________ (填“偏高”“偏低”或“不变”)。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12]
(5)产品中POCl3的质量分数为___________ 。
已知:PCl3、POCl3的部分性质如下:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 |
| PCl3 | -112 | 75.5 | 137.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 153.5 | 遇水生成H3PO4和HCl |

(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为
(2)装置 E 反应的离子方程式为
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:
(5)产品中POCl3的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网