解答题-结构与性质 适中0.65 引用5 组卷506
国内外学者近年来对金属-有机框架(MOFs)作为催化剂光解制氢和还原CO2等方面的研究取得了丰硕的成果。其中Masaya 等人利用Ti- MOF-NH2、H2PtCl6、 DMF 等原料制备了催化剂Pt/Ti- MOF-NH2,回答下列问题:
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是_______ ,处于_______ 区,未成对电子数是_______ 。
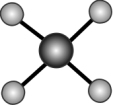
(2)PtCl 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是_______ , 中心原子采用的杂化类型可能是_______ (填 “dsp2”“sp3”“sp2”或“sp3d2”)。
(3)DMF的结构是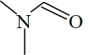 ,σ键与π键的数目比是
,σ键与π键的数目比是_______ ,其中N原子的杂化方式是_______ 。
(4)已知pKa=-lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因_______ 。
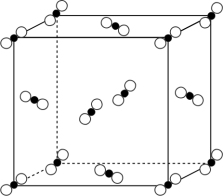
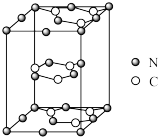
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。若阿伏加德罗常数为NA, 干冰的密度为ρg·cm-3, 则晶胞体对角线长度是_______ cm。
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是
(2)PtCl

(3)DMF的结构是
 ,σ键与π键的数目比是
,σ键与π键的数目比是(4)已知pKa=-lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。若阿伏加德罗常数为NA, 干冰的密度为ρg·cm-3, 则晶胞体对角线长度是

2022·福建龙岩·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


 b.
b.


 )的阴离子(
)的阴离子(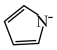 )形成双吡咯铜。
)形成双吡咯铜。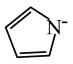 中C和N原子的杂化均为
中C和N原子的杂化均为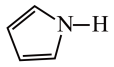 含有
含有 )2中含有的化学键有
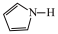
)2中含有的化学键有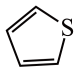 )的沸点为84℃,吡咯(
)的沸点为84℃,吡咯(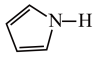 )的沸点在129 ~131℃之间,吡咯沸点较高,其原因是
)的沸点在129 ~131℃之间,吡咯沸点较高,其原因是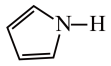 中的大
中的大


