解答题-原理综合题 适中0.65 引用3 组卷319
二氧化碳、甲烷等是主要的温室气体。研发二氧化碳和甲烷的利用技术对治理生态环境具有重要意义。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=a kJ•mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=b kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH3=c kJ•mol-1
则催化重整反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的ΔH4=
2CO(g)+2H2(g)的ΔH4=_______ 。
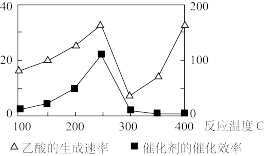
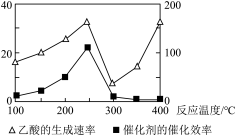
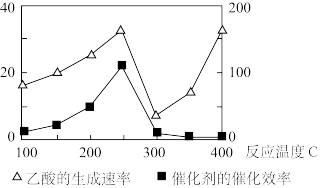
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因可能是_______ 。
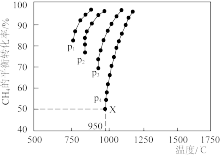
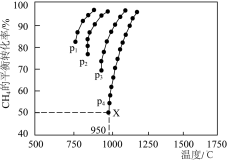
(3)催化重整反应 CO2(g)+CH4(g) 2CO(g)+2H2(g)中,测得CH4的平衡转化率与温度及压强的关系如图所示:
2CO(g)+2H2(g)中,测得CH4的平衡转化率与温度及压强的关系如图所示:
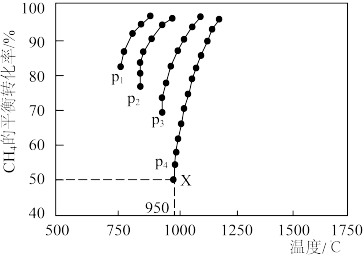
①由图可知,p1、p2、p3、p4由大到小的顺序为_______ 。
②在压强为p4、投料比n(CH4)/n(CO2)为1、950℃的条件下,X点平衡常数Kp=_______
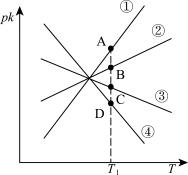
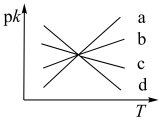
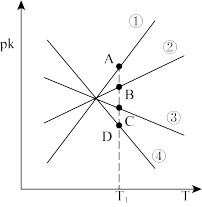
(4)若反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.17kJ•mol-1的正、逆反应速率分别可表示为v正=k正c(CO2)•c(H2)、v逆=k逆c(CO)•c(H2O),则如图所示①②③④四条斜线中,能表示pk正随T变化关系的是斜线
CO(g)+H2O(g) ΔH2=+41.17kJ•mol-1的正、逆反应速率分别可表示为v正=k正c(CO2)•c(H2)、v逆=k逆c(CO)•c(H2O),则如图所示①②③④四条斜线中,能表示pk正随T变化关系的是斜线_______ ,能表示pk逆随T变化关系的是斜线_______ (pk=-lgk)。
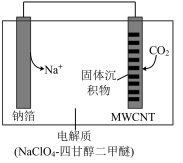
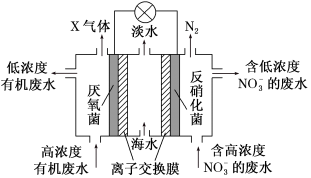
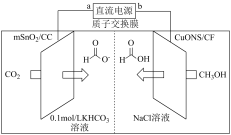
(5)一种CO2电还原装置如图所示:
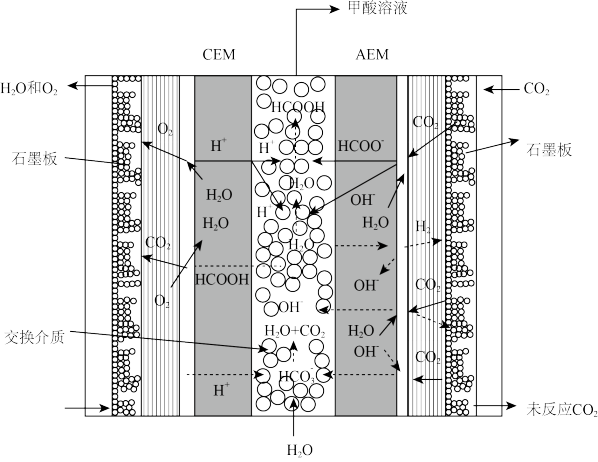
写出阴极的电极反应方程式:_______ 。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=a kJ•mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=b kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH3=c kJ•mol-1
则催化重整反应CO2(g)+CH4(g)
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因可能是

(3)催化重整反应 CO2(g)+CH4(g)

①由图可知,p1、p2、p3、p4由大到小的顺序为
②在压强为p4、投料比n(CH4)/n(CO2)为1、950℃的条件下,X点平衡常数Kp=
(4)若反应CO2(g)+H2(g)

(5)一种CO2电还原装置如图所示:

写出阴极的电极反应方程式:
2022·湖南·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网