解答题-实验探究题 适中0.65 引用4 组卷278
EDTA(乙二胺四乙酸)是螯合剂的代表物(沸点为116~117.2℃),可用于制备EDTAFeNa·3H2O等。实验室制备EDTA的实验步骤如下:
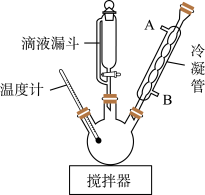
步骤1:在三口烧瓶中加入22.5 g ClCH2COOH、45 mL H2O搅拌至溶解;在不断搅拌下,将含22 g NaOH、60 mL H2O、6.6 g H2NCH2CH2NH2的盐酸盐所配成的溶液,从滴液漏斗中不断滴加到三口烧瓶中。
步骤2:加料完毕后,升温到102~106 ℃并保温,调节并保持 pH约为9,搅拌2 h。
步骤3:加入活性炭,搅拌、静置、过滤。
步骤4:滤液用盐酸酸化至pH=1,放置、结晶、过滤、洗涤、干燥,制得EDTA。
(1)图中冷凝管装置的作用是_____ ,水从接口_____ (填标号)通入。
(2)步骤3中加入活性炭的目的是_____ ;测定溶液pH的方法是_____ 。
(3)步骤4中“洗涤”时,能说明已洗涤完全的方法是_____ 。
(4)请补充完整由EDTA、NaHCO3、FeCl3·6H2O为原料制备EDTAFeNa·3H2O的实验方案(已知EDTANa4+FeCl3 EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160 mL蒸馏水、23 g EDTA,搅拌至完全溶解,
EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160 mL蒸馏水、23 g EDTA,搅拌至完全溶解,_____ ,再分次加入21.6 g FeCl3·6H2O,保温20 min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用 的试剂为:NaHCO3,用量为26.8 g)。

步骤1:在三口烧瓶中加入22.5 g ClCH2COOH、45 mL H2O搅拌至溶解;在不断搅拌下,将含22 g NaOH、60 mL H2O、6.6 g H2NCH2CH2NH2的盐酸盐所配成的溶液,从滴液漏斗中不断滴加到三口烧瓶中。
步骤2:加料完毕后,升温到102~106 ℃并保温,调节并保持 pH约为9,搅拌2 h。
步骤3:加入活性炭,搅拌、静置、过滤。
步骤4:滤液用盐酸酸化至pH=1,放置、结晶、过滤、洗涤、干燥,制得EDTA。
(1)图中冷凝管装置的作用是
(2)步骤3中加入活性炭的目的是
(3)步骤4中“洗涤”时,能说明已洗涤完全的方法是
(4)请补充完整由EDTA、NaHCO3、FeCl3·6H2O为原料制备EDTAFeNa·3H2O的实验方案(已知EDTANa4+FeCl3
2019·江苏南京·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 +(CH3CO)2O
+(CH3CO)2O +CH3COOH
+CH3COOH

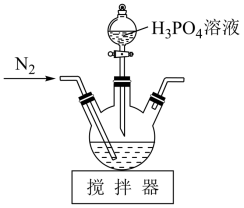
 ,白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:
,白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:

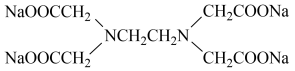 +4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为
+4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为

