解答题-实验探究题 较难0.4 引用8 组卷958
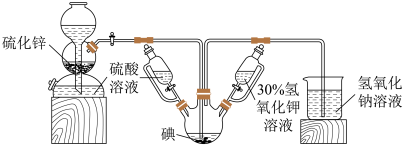
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。KI还可用于分析试剂、感光材料、制药等,其制备原理如下:
反应I:3I2+ 6KOH= KIO3 +5KI+ 3H2O
反应II:3H2S+KIO3=3S ↓+KI+ 3H2O
请回答有关问题。
(1)启普发生器中发生反应的化学方程式为_______ 。装置中盛装30%氢氧化钾溶液的仪器名称是_______ 。
(2)关闭启普发生器活塞,先滴入30%的KOH溶液,待观察到三颈烧瓶中溶液颜色由棕黄色变为_______ (填现象),停止滴入KOH溶液,然后_______ (填操作),待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的_______ 。
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有硫酸钡和_______ (填名称)。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
(5)实验室模拟工业制备KIO3流程如下:
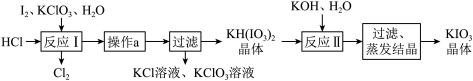
几种物质的溶解度见下表:
①由上表数据分析可知,“操作a”为_______ 。
②用惰性电极电解KI的碱性溶液也能制备KIO3,阳极反应式为_______ ;与电解法相比,上述流程制备 KIO3的缺点是_______ 。
(6)某同学测定上述流程生产的KIO3样品的纯度。取1.00 g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0 mol/LNa2S2O3溶液,恰好完全反应时共消耗12. 00 mL Na2S2O3溶液。该样品中KIO3的质量分数为_______ ( 已知反应:I2+2Na2S2O3=2NaI+Na2S4O6)
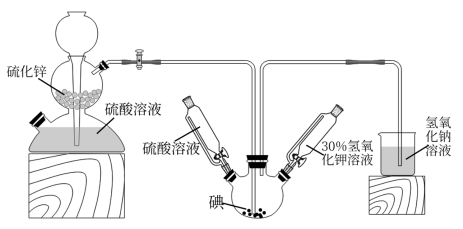
反应I:3I2+ 6KOH= KIO3 +5KI+ 3H2O
反应II:3H2S+KIO3=3S ↓+KI+ 3H2O

请回答有关问题。
(1)启普发生器中发生反应的化学方程式为
(2)关闭启普发生器活塞,先滴入30%的KOH溶液,待观察到三颈烧瓶中溶液颜色由棕黄色变为
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有硫酸钡和
(5)实验室模拟工业制备KIO3流程如下:

几种物质的溶解度见下表:
| KCl | KH(IO3)2 | KClO3 | |
| 25℃时的溶解度(g) | 20.8 | 0.8 | 7.5 |
| 80℃时的溶解度(g) | 37.1 | 12.4 | 16.2 |
②用惰性电极电解KI的碱性溶液也能制备KIO3,阳极反应式为
(6)某同学测定上述流程生产的KIO3样品的纯度。取1.00 g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0 mol/LNa2S2O3溶液,恰好完全反应时共消耗12. 00 mL Na2S2O3溶液。该样品中KIO3的质量分数为
2022·天津宁河·模拟预测
类题推荐
KI可用于分析试剂、感光材料、制药和食品添加剂等。制备原理如下:
反应①3I2+6KOH=KIO3+5KI+3H2O;反应②3H2S+KIO3=3S↓+KI+3H2O。该实验的主要步骤如下:
步骤a:关闭活塞K1,打开K3,碘单质充分反应后,关闭K3。
步骤b:打开K1,通入足量硫化氢气体,然后再关闭K1。
步骤c:打开K2,加入硫酸同时加热,关闭K2。
步骤d:将反应液转移到烧杯中,加入碳酸钡,充分反应后过滤、洗涤。
步骤e:合并滤液和洗涤液,处理后得到产品。
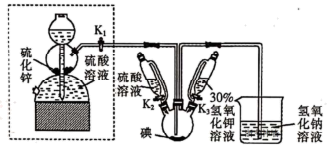
按照下列实验过程,请回答有关问题。
(1)步骤a中,当观察到______ (填现象)时才能关闭K3。
(2)实验过程中,下列说法错误的是______________ 。
A.虚线框中的仪器为启普发生器,还可以用来制备SO2
B.步骤b中,当观察到三颈烧瓶中硫化氢气泡的逸出速度与烧杯中的接近时可关闭K1
C.步骤c中,溶液酸化后加热,有利于H2S溢出,除去H2S
D.步骤d中,加入碳酸钡的作用是除去多余的硫酸,过滤得到的沉淀中只含有硫酸钡和过量碳酸钡
(3)根据碘化钾的溶解度随温度变化情况,选择恰当的选项对步骤e中实验操作进行排序:a→____ →b。
a.将滤液和洗涤液混合后加入蒸发皿中
b.取出晶体,用干净滤纸吸干,称重
c.减压过滤
d.酒精灯加热浓缩至溶液中出现大量晶体,停止加热
e.用少量蒸馏水洗涤晶体2-3次
f.沸水浴加热蒸发浓缩至溶液表面出现晶膜,停止加热
g.室温条件下放置自然冷却
h.用少量酒精溶液洗涤晶体2-3次
(4)在实验所需溶液配制过程中,下列说法正确的是__________ 。
A.检漏时发现容量瓶漏水,可以在瓶塞和瓶口内侧涂抹少量凡士林以防漏水
B.容量瓶在检漏和洗净后,可以放置在烘箱内低温烘干备用
C.转移和洗涤操作后,应将容量瓶按下图方式摇晃初步混匀,再进行定容
D.配制完成的溶液应转移至试剂瓶中贮存,洗净的试剂瓶应先用该溶液润洗2-3次
(5)纯净的碘化钾为白色颗粒状固体,所得产品略带黄色,请分析原因:____________ 。
反应①3I2+6KOH=KIO3+5KI+3H2O;反应②3H2S+KIO3=3S↓+KI+3H2O。该实验的主要步骤如下:
步骤a:关闭活塞K1,打开K3,碘单质充分反应后,关闭K3。
步骤b:打开K1,通入足量硫化氢气体,然后再关闭K1。
步骤c:打开K2,加入硫酸同时加热,关闭K2。
步骤d:将反应液转移到烧杯中,加入碳酸钡,充分反应后过滤、洗涤。
步骤e:合并滤液和洗涤液,处理后得到产品。

按照下列实验过程,请回答有关问题。
(1)步骤a中,当观察到
(2)实验过程中,下列说法错误的是
A.虚线框中的仪器为启普发生器,还可以用来制备SO2
B.步骤b中,当观察到三颈烧瓶中硫化氢气泡的逸出速度与烧杯中的接近时可关闭K1
C.步骤c中,溶液酸化后加热,有利于H2S溢出,除去H2S
D.步骤d中,加入碳酸钡的作用是除去多余的硫酸,过滤得到的沉淀中只含有硫酸钡和过量碳酸钡
(3)根据碘化钾的溶解度随温度变化情况,选择恰当的选项对步骤e中实验操作进行排序:a→
| 碘化钾的溶解度/g | |||
| 6°C | 20℃ | 60°C | 100°C |
| 128 | 140 | 176 | 206 |
b.取出晶体,用干净滤纸吸干,称重
c.减压过滤
d.酒精灯加热浓缩至溶液中出现大量晶体,停止加热
e.用少量蒸馏水洗涤晶体2-3次
f.沸水浴加热蒸发浓缩至溶液表面出现晶膜,停止加热
g.室温条件下放置自然冷却
h.用少量酒精溶液洗涤晶体2-3次
(4)在实验所需溶液配制过程中,下列说法正确的是
A.检漏时发现容量瓶漏水,可以在瓶塞和瓶口内侧涂抹少量凡士林以防漏水
B.容量瓶在检漏和洗净后,可以放置在烘箱内低温烘干备用
C.转移和洗涤操作后,应将容量瓶按下图方式摇晃初步混匀,再进行定容
D.配制完成的溶液应转移至试剂瓶中贮存,洗净的试剂瓶应先用该溶液润洗2-3次

(5)纯净的碘化钾为白色颗粒状固体,所得产品略带黄色,请分析原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网