解答题-原理综合题 较难0.4 引用2 组卷207
当今中国积极推进绿色低碳发展,力争在2030年前实现碳达峰,2060年前实现碳中和。因此,研发CO2利用技术,降低空气中CO2含量成为研究热点。以CO2、H2为原料同时发生反应Ⅰ、Ⅱ如下:
反应Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1 K1
CH3OH(g)+H2O(g) △H1 K1
反应Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2 K2
CO(g)+H2O(g) △H2 K2
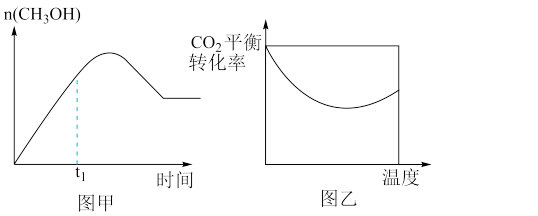
(1)如图1所示,则△H1-△H2____ 0(填“>”、“<”或“=”)。
(2)一定条件下,向体积为2L的恒容密闭容器中通入0.1molCO2和0.3molH2发生上述反应,达到平衡时,容器中CH3OH为0.02mol,CO为0.04mol,此时CO2的转化率为____ 。反应Ⅰ的化学平衡常数K1=_____ 。
(3)CO2也可以与NH3合成尿素,反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0,分为两步:
CO(NH2)2(l)+H2O(g) △H<0,分为两步:
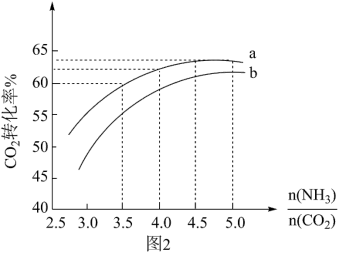
已知投料的组成为CO2、NH3和水蒸气(有助于分离尿素),一定条件下,不同氨碳比 与水碳比
与水碳比 投料时CO2平衡转化率图象(图2,其中a、b代表水碳比):下列叙述正确的是
投料时CO2平衡转化率图象(图2,其中a、b代表水碳比):下列叙述正确的是_____ 。
(4)CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。例如:HCO 催化储氢,在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为HCO
催化储氢,在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为HCO +H2
+H2 HCOO-+H2。若其他条件不变,HCO
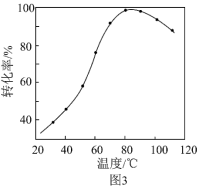
HCOO-+H2。若其他条件不变,HCO 转化为HCOO-的转化率随温度的变化如图3所示。反应温度在80℃~120℃范围内,HCO
转化为HCOO-的转化率随温度的变化如图3所示。反应温度在80℃~120℃范围内,HCO 催化加氢的转化率下降的可能原因是
催化加氢的转化率下降的可能原因是_____ (至少两点理由)。
反应Ⅰ.CO2(g)+3H2(g)
反应Ⅱ.CO2(g)+H2(g)
(1)如图1所示,则△H1-△H2

(2)一定条件下,向体积为2L的恒容密闭容器中通入0.1molCO2和0.3molH2发生上述反应,达到平衡时,容器中CH3OH为0.02mol,CO为0.04mol,此时CO2的转化率为
(3)CO2也可以与NH3合成尿素,反应为:2NH3(g)+CO2(g)
| 反应步骤 | 反应方程式 | |
| Ⅰ | 2NH3(g)+CO2(g) | 快速放热 |
| Ⅱ | NH2COONH4(l) | 慢速吸热 |

| A.反应Ⅰ的活化能大于反应Ⅱ,△HⅠ<△HⅡ |
| B.增大氨碳比有利于提高尿素产率,原因之一是过量氨气与反应Ⅱ生成的水反应,促进平衡正移 |
| C.实际生产中若选择曲线a,则氨碳比应控制在4.0左右 |
| D.曲线a的水碳比大于曲线b,减小水碳比有利于尿素生成 |

21-22高二下·浙江·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网