解答题-结构与性质 适中0.65 引用1 组卷89
Ⅰ.铁是地壳中含量第二位的金属元素,其单质、合金及众多的化合物在生产生活中都有广泛的应用,请回答下问题:
(1)写出铁元素在周期表中的位置:_____ ;写出Fe2+的价电子排布式_____ 。
(2)某种铁的化合物俗称“绿矾”,化学式为FeSO4•7H2O,“绿矾”中SO 的空间构型为
的空间构型为____ (用文字描述),其中S的杂化轨道类型为_____ 。
Ⅱ.铁能形成多种配合物,其中一种配合物Fe(CO)5的熔点为-20℃,沸点为103℃,可用于制备纯铁,请回答下列问题:
(3)Fe(CO)5晶体类型属于____ 晶体,配体为:____ 。
(4)价电子数和原子数相同的分子、离子或原子团互称为等电子体,往往具有相似的化学键和构型,请写出与CO互为等电子体的一种阴离子的电子式:____ 。
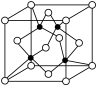
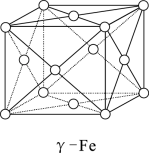
(5)γ—Fe晶体的晶胞为立方晶胞,结构如图所示,其晶胞边长为apm,则γ—Fe单质的密度为____ g/cm3(设NA为阿伏加德罗常数的值,列出算式即可)
(1)写出铁元素在周期表中的位置:
(2)某种铁的化合物俗称“绿矾”,化学式为FeSO4•7H2O,“绿矾”中SO
Ⅱ.铁能形成多种配合物,其中一种配合物Fe(CO)5的熔点为-20℃,沸点为103℃,可用于制备纯铁,请回答下列问题:
(3)Fe(CO)5晶体类型属于
(4)价电子数和原子数相同的分子、离子或原子团互称为等电子体,往往具有相似的化学键和构型,请写出与CO互为等电子体的一种阴离子的电子式:
(5)γ—Fe晶体的晶胞为立方晶胞,结构如图所示,其晶胞边长为apm,则γ—Fe单质的密度为

21-22高二下·浙江·期中
类题推荐
钴单质及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态Co的价电子排布图为___________ ,Co和Fe的逐级电离能 如表,Fe的
如表,Fe的 大于Co的
大于Co的 原因是
原因是___________ 。
(2)维生素 是配合物,其配体是一种称为卟啉的大环有机化合物,中心离子是钴离子,结构如图1所示:
是配合物,其配体是一种称为卟啉的大环有机化合物,中心离子是钴离子,结构如图1所示:
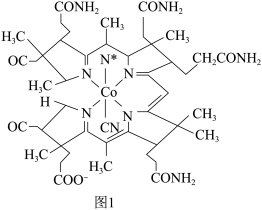
 的配位数为
的配位数为___________ ,与 形成配位键时,作配位原子的是
形成配位键时,作配位原子的是___________ 原子, 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为___________ ,与 互为等电子体的分子为
互为等电子体的分子为___________ (写一种即可)。
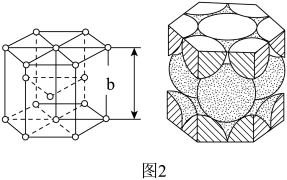
(3)金属钴晶体的晶胞是六棱柱形,其结构如图2所示,每个晶胞中含Co原子个数为___________ ;晶胞的底是正六边形,边长为a pm,设 为阿伏加德罗常数的值,晶胞的密度为
为阿伏加德罗常数的值,晶胞的密度为 ,则该晶胞的高b为
,则该晶胞的高b为___________ pm(列出计算式)。
(1)基态Co的价电子排布图为
| 元素 | … | |||||
| Fe | 462.5 | 1561.9 | 2957 | 5290 | 7240 | |
| Co | 760.4 | 1648 | 3232 | 4950 | 7670 |

(3)金属钴晶体的晶胞是六棱柱形,其结构如图2所示,每个晶胞中含Co原子个数为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网