解答题-原理综合题 较难0.4 引用2 组卷256
蕴藏在海底的大量“可燃冰”(甲烷的水合物)是一种清洁燃料,其开发利用是解决能源危机的重要课题。在一定条件下 与
与 可发生反应:
可发生反应:

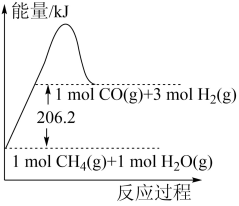
 ,该反应的能量变化如下图所示。
,该反应的能量变化如下图所示。
请回答下列问题:
(1)请用电子式表示CH4的形成过程_______ 。
(2)在一定条件下,由一定量的 和
和 反应生成了
反应生成了 和6molH2(g)时所吸收的热量为
和6molH2(g)时所吸收的热量为_______ kJ。
(3)下列措施中可以加快该反应的化学反应速率的是_______  填字母
填字母 。
。
A.恒温恒容条件下,向其中充入
B.恒温恒压条件下,向其中充入
C.恒温恒容条件下,向其中充入
D.其他条件不变,降低温度
E.其他条件不变,减小容器的体积
F.其他条件不变,及时分离出生成的H2
(4)T℃下,在容积为2L的恒容密闭容器中通入 和
和 发生该反应。
发生该反应。
①下列说法中能证明该反应已达到化学平衡状态的是_______  填字母
填字母 。
。
A.单位时间内消耗
 的同时生成了
的同时生成了
B.一个 键断裂的同时有三个
键断裂的同时有三个 键断裂
键断裂
C.密闭容器中混合气体的密度不再变化
D.混合气体的平均相对分子质量不再变化
E.
F.密闭容器内总压强不再变化
②若该反应达到化学平衡状态时,容器内气体的压强变为起始压强的1.6倍,则达平衡时 的转化率为
的转化率为_______ ,CO的体积分数为_______ %(计算结果保留一位小数 )。

请回答下列问题:
(1)请用电子式表示CH4的形成过程
(2)在一定条件下,由一定量的
(3)下列措施中可以加快该反应的化学反应速率的是
A.恒温恒容条件下,向其中充入
B.恒温恒压条件下,向其中充入
C.恒温恒容条件下,向其中充入
D.其他条件不变,降低温度
E.其他条件不变,减小容器的体积
F.其他条件不变,及时分离出生成的H2
(4)T℃下,在容积为2L的恒容密闭容器中通入
①下列说法中能证明该反应已达到化学平衡状态的是
A.单位时间内消耗
B.一个
C.密闭容器中混合气体的密度不再变化
D.混合气体的平均相对分子质量不再变化
E.
F.密闭容器内总压强不再变化
②若该反应达到化学平衡状态时,容器内气体的压强变为起始压强的1.6倍,则达平衡时
21-22高一下·湖北孝感·期中
类题推荐
CO和H2可作为能源和化工原料,应用十分广泛。常利用煤气化过程中生成的CO和H2来制备甲醇。

(1)请根据图示写出该反应的热化学方程式:_______________ ;图中使用催化剂曲线是_______ (填“a”或“b”)。
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=______________ kJ/mol。
(3)反应CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
①从上表可以推断:此反应是__________ (填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为___________________ 。
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________ (填字母标号)。
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=__________ mol/(L·min)。
③25 min时,物质浓度变化如图所示,则改变的条件可能是________ (填字母标号)。

A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度

(1)请根据图示写出该反应的热化学方程式:
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=
(3)反应CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:①能说明该反应达到平衡状态的是
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=
③25 min时,物质浓度变化如图所示,则改变的条件可能是

A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网