填空题 适中0.65 引用1 组卷101
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。请回答下列问题。
(1)工业合成氨反应 是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知
是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知 完全反应生成
完全反应生成 可放出92kJ热量。如果将
可放出92kJ热量。如果将 和足量
和足量 混合,使其充分反应,放出的热量
混合,使其充分反应,放出的热量_______ (填“大于”“小于”或“等于”)920kJ。
(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成 。
。
①反应过程中形成的化学键是_______ (填写“离子键”或“共价键”)。
②一定条件下,能说明该反应进行到最大限度的是_______ (填字母)。
a. 的转化率达到最大值
的转化率达到最大值
b. 、
、 和
和 的体积分数之比为1:3:2
的体积分数之比为1:3:2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
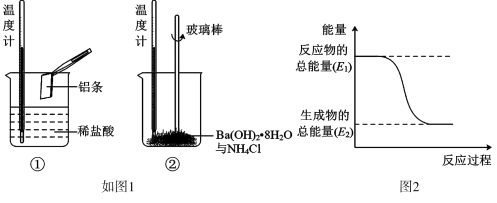
(3)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化,请根据你掌握的反应原理判断,反应后溶液的温度_______ (填“升高”或“降低”),反应物的能量_______ 产物的能量(填写“高于”、“低于”)。
(4)用 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
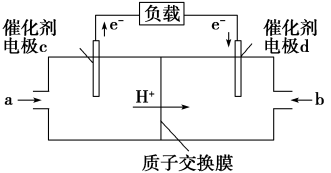
①则电极d是_______ (填“正根”或“负极”),电极c的电极反应式为_______ 。
②若线路中转移 电子,则该燃料电池理论上消耗的
电子,则该燃料电池理论上消耗的 在标准状况下的体积为
在标准状况下的体积为_______ L。
(1)工业合成氨反应
(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成
①反应过程中形成的化学键是
②一定条件下,能说明该反应进行到最大限度的是
a.
b.
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
(3)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化,请根据你掌握的反应原理判断,反应后溶液的温度

(4)用

①则电极d是
②若线路中转移
21-22高一下·广西河池·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网