解答题-实验探究题 适中0.65 引用2 组卷102
Ⅰ.某工厂的酸性废水中主要含有Fe3+、Cu2+等离子,为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾(FeSO4·7H2O)。
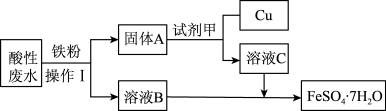
(1)操作1是_______ ;试剂甲是_______ (填化学式)。
(2)获得的FeSO4·7H2O需密闭保存,原因是_______ 。
(3)绿矾可消除某种酸性工业废水中+6价铬( )的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是
)的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是_______ 。
(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是_______ (填化学式)。
Ⅱ.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
氧化性强弱探究:
【分析与解释】
(5)实验Ⅰ中a试管中反应的离子方程式是_______ 。
(6)通过实验Ⅰ可以得出的结论是_______ 。
(7)①甲同学认为:实验Ⅱ观察到_______ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
补做实验Ⅲ的目的是_______ 。

(1)操作1是
(2)获得的FeSO4·7H2O需密闭保存,原因是
(3)绿矾可消除某种酸性工业废水中+6价铬(
(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是
Ⅱ.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
氧化性强弱探究:
| 实验Ⅰ | 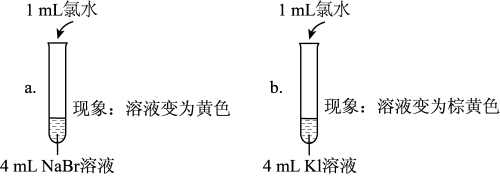 |
| 实验Ⅱ | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验Ⅰ中a试管中反应的离子方程式是
(6)通过实验Ⅰ可以得出的结论是
(7)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
| 实验Ⅲ | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
21-22高一上·河北衡水·阶段练习
类题推荐
某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。氧化性强弱探究:
【分析与解释】
(1)实验Ⅰ中a试管中反应的离子方程式是_____ 。
(2)①甲同学认为:实验Ⅱ观察到_____ 现象,得出氧化性:Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性:Br2>I2;他补做了实验Ⅲ。补做实验Ⅲ的目的是_____ 。
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。氧化性强弱探究:
| 实验Ⅰ |  |
| 实验Ⅱ | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
| 实验Ⅲ | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
(1)实验Ⅰ中a试管中反应的离子方程式是
(2)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性:Br2>I2;他补做了实验Ⅲ。补做实验Ⅲ的目的是
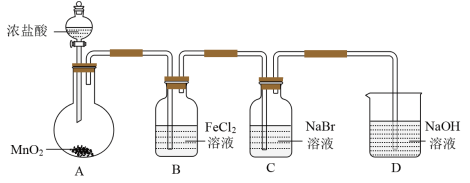
某研究小组利用下图所示装置制备氯气,并进行Cl2、Br2、I2性质的探究。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)

(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为________ 。
(2)B中发生反应的离子方程式为_____________ 。
(3)D中发生反应的化学方程式为_____________ 。
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
【分析与解释】
(4)实验1中a试管中反应的离子方程式是_____________ 。
(5)通过实验1可以得出的结论是_______________ 。
(6)①甲同学认为:实验2观察到______________ 现象,得出氧化性Br2>I2;
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3。
补做实验3的目的是_____________ 。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)

(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为
(2)B中发生反应的离子方程式为
(3)D中发生反应的化学方程式为
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
| 实验1 | 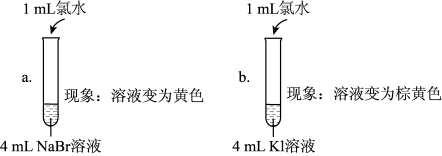 |
| 实验2 | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(4)实验1中a试管中反应的离子方程式是
(5)通过实验1可以得出的结论是
(6)①甲同学认为:实验2观察到
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3。
| 实验3 | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
某研究小组利用如图所示装置制备氯气,并进行Cl2、Br2、I2性质的探究。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为_______ 。
(2)B中发生反应的离子方程式为_______ 。
(3)D中发生反应的化学方程式为_______ 。
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:______
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
【分析与解释】
(5)实验1中a试管中反应的离子方程式是_______ 。
(6)通过实验1可以得出的结论是_______ 。
(7)①甲同学认为:实验2观察到_______ 现象,得出氧化性Br2>I2;
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
补做实验3的目的是_______ 。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)

(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为
(2)B中发生反应的离子方程式为
(3)D中发生反应的化学方程式为
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
| 实验1 | 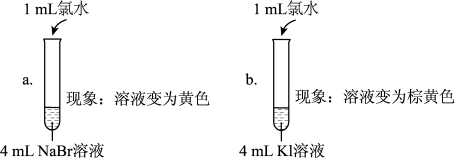 |
| 实验2 | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验1中a试管中反应的离子方程式是
(6)通过实验1可以得出的结论是
(7)①甲同学认为:实验2观察到
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
| 实验3 | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


