解答题-原理综合题 较难0.4 引用10 组卷1516
清洁能源的综合利用可有效降低碳排放,是实现“碳中和、碳达峰”的重要途径。
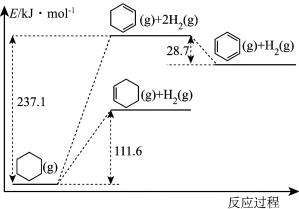
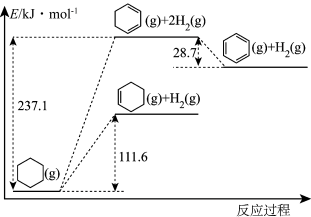
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。
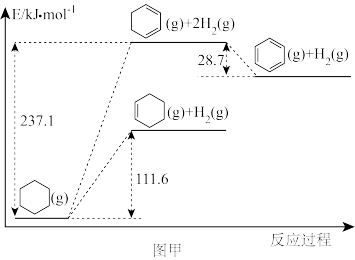
芳构化反应: (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) 
_______ kJ/mol。
(2) 和
和 合成乙醇反应为:
合成乙醇反应为: 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
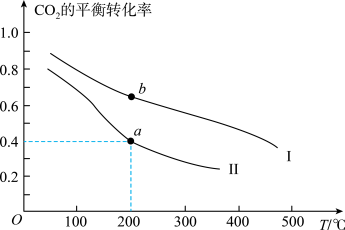
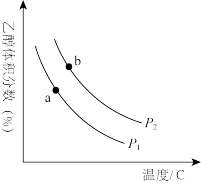
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的关系如图乙。
的体积分数随温度和压强的关系如图乙。
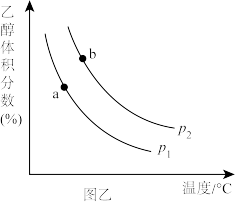
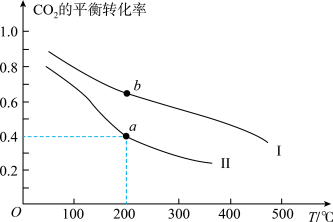
①压强P1_______ P2(填“>”“=”或“<”,下同),a、b两点的平衡常数Ka_______ Kb。
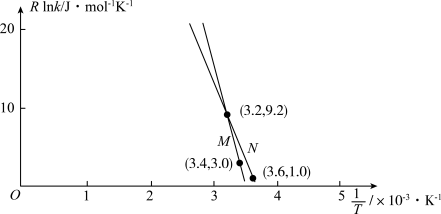
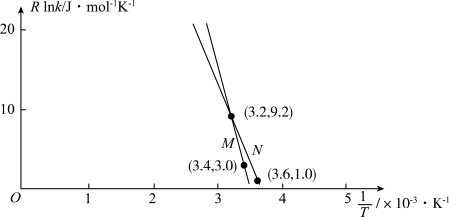
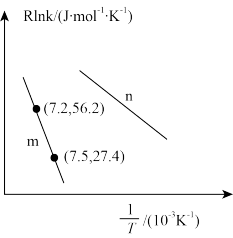
②已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
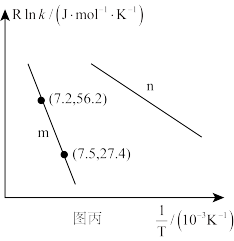
在m催化剂作用下,该反应的活化能
_______ J/mol。从图中信息获知催化效能较高的催化剂是_______ (填“m”或“n”),判断理由是_______ 。
(3) 和CO合成甲烷反应为:
和CO合成甲烷反应为: 。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率
。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下 。反应达平衡时测得v正=
。反应达平衡时测得v正= 。CO的平衡转化率为
。CO的平衡转化率为_______ ,该温度下反应的Kp=_______  (用组分的分压计算的平衡常数)。
(用组分的分压计算的平衡常数)。
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。

芳构化反应:
 (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) (2)

①压强P1
②已知Arrhenius经验公式为

在m催化剂作用下,该反应的活化能
(3)
2022·山东青岛·一模
知识点:盖斯定律及其有关计算根据△H=生成物的总能量之和-反应物的总能量之和进行计算化学平衡的移动及其影响因素化学平衡常数的有关计算 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 ΔH=
ΔH=