解答题-实验探究题 适中0.65 引用2 组卷114
氨气是重要的化工原料,在工农业生产中有重要用途。
(1)工业上合成氨的反应原理为_______ 。
(2)氨气极易溶于水,这个性质可以利用如图装置进喷泉实验。
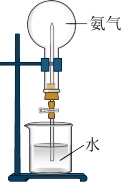
①完成喷泉实验的具体操作为_______ 。
②若该条件为标准状况,且水充满整个圆底烧瓶,则最终所得溶液的物质的量浓度为_______ 。
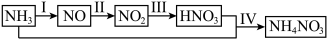
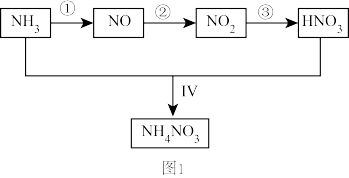
某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程。NH3的转化过程如图1所示。
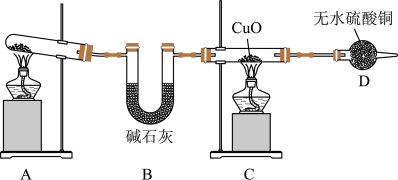
甲、乙两同学分别按图2所示装置进行实验。用于A、B装置中的可选药品:浓氨水、30% H2O2溶液、蒸馏水、NaOH固体、MnO2。
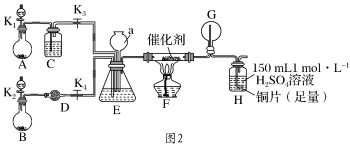
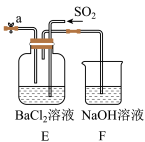
(3)装置A的圆底烧瓶中发生反应的化学方程式为_______ 。装置E有多种作用,下列关于装置E的作用或其中所盛液体的说法中,不正确的是_______ (填字母)。
a.使氨气和氧气充分混合
b.控制通入氨气和氧气的体积比
c.平衡装置内的压强
d.锥形瓶内液体是饱和食盐水
(4)甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,成功模拟了反应过程,并将实验中产生的气体持续通入装置H一段时间后,装置H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为_______ ,若制得的氨气仅按①→②→③的顺序完全转化为硝酸,欲使装置H中所得溶液为纯净的CuSO4溶液,理论上所需氨气在标准状况下的体积为_______ L(假设硝酸与铜反应产生的还原产物全部排出反应装置)。
(5)乙同学为模拟过程Ⅳ的反应,在甲同学操作的基础上对该装置进行了下列各项中的一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是_______ (填字母)。
a.关闭K3并熄灭酒精灯
b.关闭K4并熄灭酒精灯
c.关闭K3、K4并熄灭酒精灯
(6)丙同学认为该系列实验装置存在一处明显的设计缺陷,你认为该设计缺陷_______ 。
(1)工业上合成氨的反应原理为
(2)氨气极易溶于水,这个性质可以利用如图装置进喷泉实验。

①完成喷泉实验的具体操作为
②若该条件为标准状况,且水充满整个圆底烧瓶,则最终所得溶液的物质的量浓度为
某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程。NH3的转化过程如图1所示。

甲、乙两同学分别按图2所示装置进行实验。用于A、B装置中的可选药品:浓氨水、30% H2O2溶液、蒸馏水、NaOH固体、MnO2。

(3)装置A的圆底烧瓶中发生反应的化学方程式为
a.使氨气和氧气充分混合
b.控制通入氨气和氧气的体积比
c.平衡装置内的压强
d.锥形瓶内液体是饱和食盐水
(4)甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,成功模拟了反应过程,并将实验中产生的气体持续通入装置H一段时间后,装置H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为
(5)乙同学为模拟过程Ⅳ的反应,在甲同学操作的基础上对该装置进行了下列各项中的一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是
a.关闭K3并熄灭酒精灯
b.关闭K4并熄灭酒精灯
c.关闭K3、K4并熄灭酒精灯
(6)丙同学认为该系列实验装置存在一处明显的设计缺陷,你认为该设计缺陷
21-22高一下·内蒙古通辽·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网