解答题-原理综合题 适中0.65 引用1 组卷89
碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用:
(1)已知下列热化学方程式:
i.CH2=CHCH3(g)+Cl2(g)=CH2ClCHClCH3(g) △H1=-133kJ·mol-1
ii.CH2=CHCH3(g)+Cl2(g)=CH2=CHCH2C1(g)+HCl(g) △H2=-100kJ·mol-1
在相同条件下,CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g)的正反应活化能Ea(正)为132kJ·mol-1,则逆反应的活化能Ea(逆)为_______ kJ·mol-1
(2)在一定条件下可发生分解反应:CH3CHO(g)=CH4(g)+CO(g)某温度下向恒容密闭容器中加入一定量CH3CHO,测得CH3CHO浓度随时间的变化如表所示:
①2~5min内用CH3CHO表示的该反应的平均反应速率为_______ 。
②一定温度下,在恒容密闭容器中充入一定量CH3CHO进行该反应,能判断反应已达到化学平衡状态的是_______ 。
A.CH4和CO的浓度比保持不变
B.容器中压强不再变化
C.4molC-H断裂同时1molC≡O生成
D.气体的密度保持不变
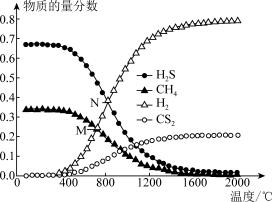
(3)在一密闭容器中,起始时向该容器中充入6molH2S和3molCH4,发生反应:CH4(g)+2H2S(g) CS2(g)+4H2(g)。在压强为0.11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:
CS2(g)+4H2(g)。在压强为0.11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:
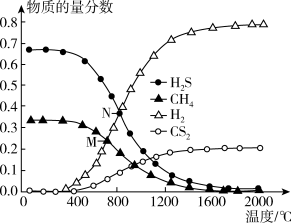
①该反应的△H_______ 0(填“>”或“<”)
②为提高H2S的平衡转化率,除改变温度外,还可采取的措施是_______ (列举一条)。N点对应温度下,该反应的Kp=_______ (MPa)2(Kp为以分压表示的平衡常数)。
(1)已知下列热化学方程式:
i.CH2=CHCH3(g)+Cl2(g)=CH2ClCHClCH3(g) △H1=-133kJ·mol-1
ii.CH2=CHCH3(g)+Cl2(g)=CH2=CHCH2C1(g)+HCl(g) △H2=-100kJ·mol-1
在相同条件下,CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g)的正反应活化能Ea(正)为132kJ·mol-1,则逆反应的活化能Ea(逆)为
(2)在一定条件下可发生分解反应:CH3CHO(g)=CH4(g)+CO(g)某温度下向恒容密闭容器中加入一定量CH3CHO,测得CH3CHO浓度随时间的变化如表所示:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量CH3CHO进行该反应,能判断反应已达到化学平衡状态的是
A.CH4和CO的浓度比保持不变
B.容器中压强不再变化
C.4molC-H断裂同时1molC≡O生成
D.气体的密度保持不变
(3)在一密闭容器中,起始时向该容器中充入6molH2S和3molCH4,发生反应:CH4(g)+2H2S(g)

①该反应的△H
②为提高H2S的平衡转化率,除改变温度外,还可采取的措施是
21-22高三上·重庆九龙坡·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网