解答题-原理综合题 适中0.65 引用4 组卷173
Ⅰ.已知:
(1)某反应的平衡常数表达式为
(2)向绝热恒容密闭容器中充入等量的
a.容器中的压强不变b.
c.气体的平均相对分子质量保持34.2不变d.该反应平衡常数保持不变
e.
Ⅱ.

(3)用离子方程式表示
(4)含
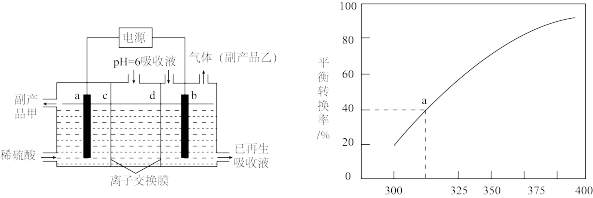
(5)
21-22高二上·安徽六安·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网