解答题-原理综合题 适中0.65 引用1 组卷110
Ⅰ。回答下列问题:
(1)标准状况下,H2、D2、T2的密度之比为_______ ,同温同压下,1LD2和T2气体中所含的中子数之比为_______ 。
(2)现有①BaCl2②Na2O2③KOH④Na2SO4⑤干冰⑥H2SO4六种物质,熔化时不需要破坏化学键的是_______ (填写物质的序号,下同),只含有离子键的物质是_______ 。
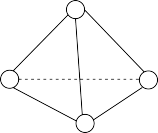
(3)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为N2时要_______ (填“吸收”或“放出”)热量_______ kJ。
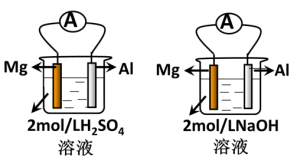
Ⅱ.某化学兴趣小组的几位同学探究原电池原理的应用时,做了如图的实验:原电池原理判断金属的活泼性。
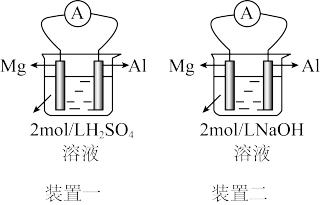
(4)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,若根据他的判断,两个装置中的Al都是_______ 极;实际实验时发现两个装置中的电流表偏转方向不同,以下的有关中判断正确的是_______ 。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
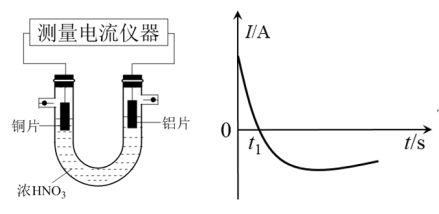
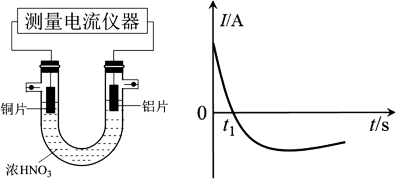
(5)乙同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是_______ 。
(1)标准状况下,H2、D2、T2的密度之比为
(2)现有①BaCl2②Na2O2③KOH④Na2SO4⑤干冰⑥H2SO4六种物质,熔化时不需要破坏化学键的是
(3)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为N2时要

Ⅱ.某化学兴趣小组的几位同学探究原电池原理的应用时,做了如图的实验:原电池原理判断金属的活泼性。

(4)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,若根据他的判断,两个装置中的Al都是
A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
(5)乙同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是

21-22高一下·河南南阳·阶段练习
类题推荐
反应Zn+H2SO4=ZnSO4+H2↑的能量变化趋势如图所示:

(1)该反应为_______ 反应(填“吸热”或“放热”)。若将上述反应设计成原电池,铜棒为原电池某一极材料,该极的电极反应为_______ 。
(2)下列化学反应在理论上可以设计成原电池的是_______(填字母)。
(3)几位同学探究原电池原理的应用时,做了如图的实验。实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,若根据他的判断,两个装置中的Al都是_______ 极。实际实验时发现两个装置中的电流表指针偏转方向相反。据此,下列说法正确的是_______ 。

A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
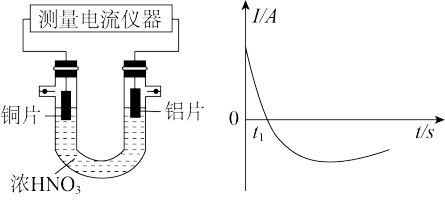
(4)而乙同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是_______ (填化学式),正极反应式(浓硝酸过量)_______ 。根据以上现象,最终他们得出结论,是实际参与反应,有损耗的电极材料为负极。
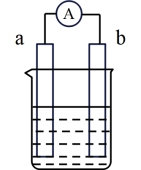
(5)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。电极a为Zn,电极b为Cu,且两电极质量相等,电解质溶液为CuSO4溶液。当该电池以稳定的电流I放电t秒后,两电极的质量差的绝对值为(已知每摩尔电子的电量为q)_______ g。

(1)该反应为
(2)下列化学反应在理论上可以设计成原电池的是_______(填字母)。
| A.CO2+H2O=H2CO3 | B.NaOH+HCl=NaCl+H2O |
| C.CO2+C | D.2H2+O2=2H2O |

A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
(4)而乙同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是

(5)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。电极a为Zn,电极b为Cu,且两电极质量相等,电解质溶液为CuSO4溶液。当该电池以稳定的电流I放电t秒后,两电极的质量差的绝对值为(已知每摩尔电子的电量为q)

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网