填空题 适中0.65 引用1 组卷152
回答下列问题:
(1)写出下列反应的热化学方程式:
①32g铜粉在足量氧气中反应生成氧化铜固体时放出78.5kJ热量:____ 。
②一氧化碳气体还原Fe3O4得到1mol单质铁时放出14.7kJ热量:____ 。
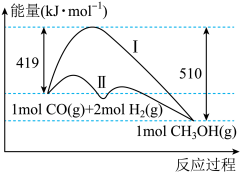
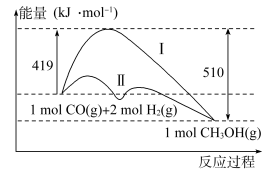
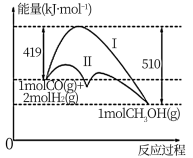
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。
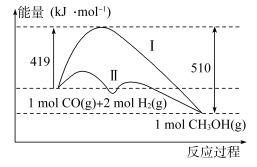
①曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。计算当反应生成1.5molCH3OH(g)时,能量变化值是____ kJ。
②选择适宜的催化剂____ (填“能”或“不能”)改变该反应的反应热。
(3)断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需____ (填“吸收”或“放出”)能量____ kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是____ 。
(1)写出下列反应的热化学方程式:
①32g铜粉在足量氧气中反应生成氧化铜固体时放出78.5kJ热量:
②一氧化碳气体还原Fe3O4得到1mol单质铁时放出14.7kJ热量:
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。

①曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。计算当反应生成1.5molCH3OH(g)时,能量变化值是
②选择适宜的催化剂
(3)断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需
21-22高一下·河北沧州·阶段练习
知识点:热化学方程式书写及正误判断根据△H=反应物的键能之和-生成物的键能之和进行计算根据△H=生成物的总能量之和-反应物的总能量之和进行计算催化剂对化学反应速率的影响 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网