解答题-结构与性质 较难0.4 引用3 组卷527
第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)镓的基态原子电子排布式是_______ 。
(2)已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是_______ 。
(3)多酚氧化酶与植物的抗病性有关。配合物 是多酚氧化酶的模型配合物。
是多酚氧化酶的模型配合物。
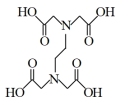 (EDTA)+
(EDTA)+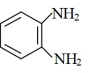 (邻苯二氨)
(邻苯二氨)
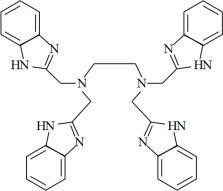 (EDTB)
(EDTB)
①EDTA中N的杂化轨道类型为_______ 。
②邻苯二胺分子中 键的数目为
键的数目为_______ 。
③EDTB分子中所含元素的电负性由小到大的顺序为_______ 。
④与 互为等电子体的一种阴离子为
互为等电子体的一种阴离子为_______ 。
⑤配离子 中的配位原子是
中的配位原子是_______ 。
(4)向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色透明溶液,向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解、后析出的原因是(用离子方程式和简单的文字说明加以解释):_______ 。
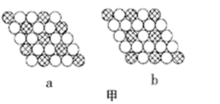
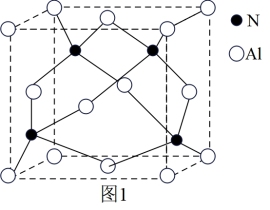
(5)氮化铝在电子工业上有广泛应用,其晶胞如图1所示。N原子所在空隙的类型是_______ (填“正四面体”“正八面体”或“立方体”)空隙,该空隙的填充率为_______ 。
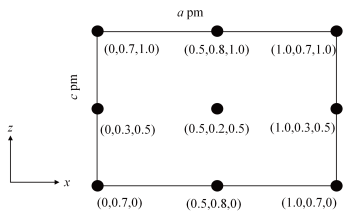
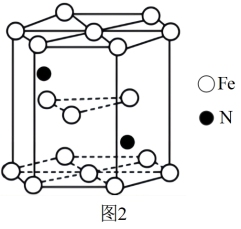
(6)铁和氮组成一种过渡金属氮化物,其结构如图2所示。直六棱柱的底边边长为xcm,高为ycm,阿伏加德罗常数的值为NA,则晶体的密度算式为_______  。
。
(1)镓的基态原子电子排布式是
(2)已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是
(3)多酚氧化酶与植物的抗病性有关。配合物
 (EDTA)+
(EDTA)+ (邻苯二氨)
(邻苯二氨) (EDTB)
(EDTB)①EDTA中N的杂化轨道类型为
②邻苯二胺分子中
③EDTB分子中所含元素的电负性由小到大的顺序为
④与
⑤配离子
(4)向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色透明溶液,向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解、后析出的原因是(用离子方程式和简单的文字说明加以解释):
(5)氮化铝在电子工业上有广泛应用,其晶胞如图1所示。N原子所在空隙的类型是

(6)铁和氮组成一种过渡金属氮化物,其结构如图2所示。直六棱柱的底边边长为xcm,高为ycm,阿伏加德罗常数的值为NA,则晶体的密度算式为

2022·湖南长沙·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网