解答题-工业流程题 适中0.65 引用2 组卷248
氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。工业上用钛铁矿(主要成分FeTiO3,钛酸亚铁,含有少量SiO2,MgO等杂质)制备氮化钛的工艺流程如下:
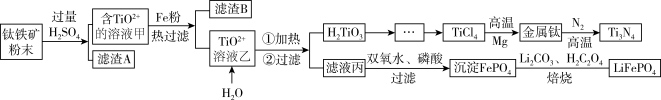
已知:钛铁矿与硫酸发生非氧化还原反应,TiOSO4遇水会水解。H2TiO3灼烧制得TiO2,TiO2与焦炭、氯气在高温下生成TiCl4。
请回答下列问题:
(1)钛铁矿加入过量硫酸后滤渣A是_______ (化学式)。
(2)钛铁矿与硫酸发生反应的化学方程式_______ 。
(3)请用化学用语解释溶液乙TiO2+转化为H2TiO3的原理_______ 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______ 。
(5)TiO2制取单质Ti涉及到的步骤如下:由TiCl4→Ti需发在Ar气中进行的理由_______ 。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到,依据表中的信息,需要加热的温度略高于 _______ 即可。
(6)用氧化还原滴定法测定TiOSO4的含量。先取待测钛液10.00 mL用水释至100 mL,加过量铝粉,充分振荡,使TiO2+还原为Ti3+,过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液,用0.1000 mol/L NH4Fe(SO4)2的标准液滴定。Ti3++Fe3+═Ti4++Fe2+,滴定终点时现象_______ ,若用去了30.00 mL NH4Fe(SO4)2溶液,待测钛液中TiOSO4的物质的量浓度是 _______ mol/L。

已知:钛铁矿与硫酸发生非氧化还原反应,TiOSO4遇水会水解。H2TiO3灼烧制得TiO2,TiO2与焦炭、氯气在高温下生成TiCl4。
请回答下列问题:
(1)钛铁矿加入过量硫酸后滤渣A是
(2)钛铁矿与硫酸发生反应的化学方程式
(3)请用化学用语解释溶液乙TiO2+转化为H2TiO3的原理
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是
(5)TiO2制取单质Ti涉及到的步骤如下:由TiCl4→Ti需发在Ar气中进行的理由
(6)用氧化还原滴定法测定TiOSO4的含量。先取待测钛液10.00 mL用水释至100 mL,加过量铝粉,充分振荡,使TiO2+还原为Ti3+,过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液,用0.1000 mol/L NH4Fe(SO4)2的标准液滴定。Ti3++Fe3+═Ti4++Fe2+,滴定终点时现象
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | ﹣25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
2022·安徽宣城·二模
类题推荐
磷酸亚铁锂 可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点。氮化钛
可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点。氮化钛 为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。工业上用钛铁矿[主要成分
为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。工业上用钛铁矿[主要成分 (钛酸亚铁),含有少量
(钛酸亚铁),含有少量 、
、 、
、 等杂质]制备氮化钛和磷酸亚铁锂的工艺流程如下:
等杂质]制备氮化钛和磷酸亚铁锂的工艺流程如下:
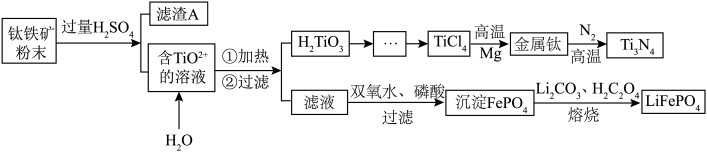
已知:①钛铁矿与硫酸的主要反应: ;
;
② 遇水会水解。
遇水会水解。
请回答下列问题:
(1)请写出加快钛铁矿与硫酸反应速率的方法___________ (至少写出两种)。
(2)滤渣A是___________ (化学式)。
(3)含 的溶液转化为
的溶液转化为 的离子方程式
的离子方程式___________ 。
(4)由 需要在Ar氛围中进行的理由
需要在Ar氛围中进行的理由___________ ;反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到钛单质,依据下表中的信息,需要加热的温度略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到钛单质,依据下表中的信息,需要加热的温度略高于___________ 即可。
(5)请写出滤液制取 的离子反应方程式
的离子反应方程式___________ 。
(6)写出熔烧制备 的化学反应方程式
的化学反应方程式___________ 。

已知:①钛铁矿与硫酸的主要反应:
②
请回答下列问题:
(1)请写出加快钛铁矿与硫酸反应速率的方法
(2)滤渣A是
(3)含
(4)由
| Mg | Ti | |||
| 熔点/℃ | 648.8 | 714 | 1667 | |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)请写出滤液制取
(6)写出熔烧制备
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:
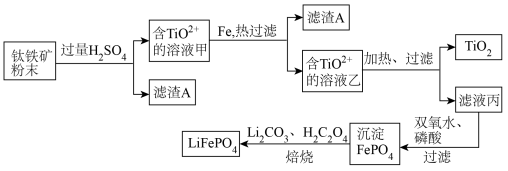
已知:FeTiO3+4H+=Fe2++TiO2++2H2O
草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是_______ 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为_______________ (填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是__________________________ 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是______ 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为__ (用代数式表示)。
(6)TiO2制取单质Ti,涉及到的步骤如下:
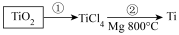
反应②的方程式是___________ 。由TiCl4→Ti需要在Ar气中进行的理由是_____________ 。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于_________ ℃即可。
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/ | 136.4 | 1090 | 1412 | 3287 |

已知:FeTiO3+4H+=Fe2++TiO2++2H2O
草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为
(6)TiO2制取单质Ti,涉及到的步骤如下:
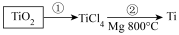
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:

已知:FeTiO3+4H+=Fe2++TiO2++2H2O,草酸(H2C2O4)具有很强还原性,易被氧化成二氧化碳。
(1)化合物FeTiO3中铁元素的化合价是___________ 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为_________________ (填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是________________________________ 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是______________ 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为________ (用代数式表示)。
(6)TiO2制取单质Ti,涉及到的步骤如下:
反应②的方程式是_________________ 。由TiCl4→Ti需要在Ar气中进行的理由是__________ 。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于_________ ℃即可。

已知:FeTiO3+4H+=Fe2++TiO2++2H2O,草酸(H2C2O4)具有很强还原性,易被氧化成二氧化碳。
(1)化合物FeTiO3中铁元素的化合价是
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为
(6)TiO2制取单质Ti,涉及到的步骤如下:
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


