解答题-原理综合题 适中0.65 引用2 组卷163
下表是25℃时某些弱酸的电离常数,其中多元弱酸分步电离。
(1)等浓度的HCOOH、 和
和 溶液中,水电离出的氢离子浓度:
溶液中,水电离出的氢离子浓度:_______ >_______ >_______ 。
(2)根据表中数据判断下述反应可以发生的是_______ 。(填编号)
①
②
③
④
(3)少量 通入NaCN溶液中发生反应的离子方程式为
通入NaCN溶液中发生反应的离子方程式为_______ 。
(4)常温下在 溶液中逐滴滴加
溶液中逐滴滴加 盐酸溶液40mL,溶液中含碳元素的三种微粒
盐酸溶液40mL,溶液中含碳元素的三种微粒 、
、 、
、 (
( 因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:
因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:
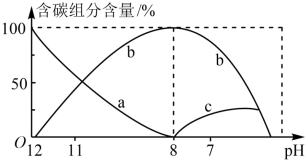
①各字母代表的粒子为b_______ ,c_______ 。
②在同一溶液中, 、
、 、
、
_______ (填“能”或“不能”)大量共存。
③当 时,溶液中含碳元素的主要微粒为
时,溶液中含碳元素的主要微粒为_______ 。
(5)若以熔融 作为电解质,写出
作为电解质,写出 燃料电池负极的电极反应式
燃料电池负极的电极反应式_______ 。
(6)等浓度等体积的 溶液和
溶液和 溶液混合,写出离子浓度由大到小的排序:
溶液混合,写出离子浓度由大到小的排序:_______ 。
| 弱酸 | K | 弱酸 | K |
| HF | |||
| HCN | |||
| HCOOH | |||
(2)根据表中数据判断下述反应可以发生的是
①
②
③
④
(3)少量
(4)常温下在

①各字母代表的粒子为b
②在同一溶液中,
③当
(5)若以熔融
(6)等浓度等体积的
21-22高三上·天津南开·阶段练习
知识点:弱电解质在水溶液中的电离平衡电离平衡常数及影响因素盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理盐溶液中离子浓度大小的比较 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
(1)将足量的NaOH溶液滴入某酸(H3A)溶液中,发生反应:NaOH+H3A=NaH2A+H2O。则酸H3A是_______ (填入“一元酸、二元酸、三元酸、不能确定”中一个)。
(2)用电离方程式解释Na2HPO4溶液中有PO 的原因
的原因_____________
(3)表中是25℃时某些弱酸的电离常数,其中多元弱酸分步电离。
根据表中数据判断下述反应可以发生的是______ (填编号)
①NaF+CH3COOH=CH3COONa+HF
②HF+NaHCO3=NaF+H2O+CO2↑
③CH3COOH+K2C2O4=CH3COOK+KHC2O4
(4)少量CO2通入NaClO溶液中发生反应的离子方程式为___________ 。
(5)常温下在20mL0.1mol/LNa2CO3溶液中逐滴滴加40ml0.1mol/L盐酸溶液,溶液中含碳元素的三种微粒H2CO3、HCO 、CO
、CO (CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
①各字母代表的粒子为b________ ,c________ 。
②在同一溶液中,H2CO3、HCO 、CO
、CO (填:“能”或“不能”)
(填:“能”或“不能”)______ 大量共存。
(2)用电离方程式解释Na2HPO4溶液中有PO
(3)表中是25℃时某些弱酸的电离常数,其中多元弱酸分步电离。
| 弱酸 | K | 弱酸 | K |
| HF | 3.53 | H2CO3 | K1=4.4 K2=4.7 |
| HClO | 2.95 | ||
| HCOOH | 1.765 | H2C2O4 | K1=5.4 K2=5.4 |
| CH3COOH | 1.753 |
①NaF+CH3COOH=CH3COONa+HF
②HF+NaHCO3=NaF+H2O+CO2↑
③CH3COOH+K2C2O4=CH3COOK+KHC2O4
(4)少量CO2通入NaClO溶液中发生反应的离子方程式为
(5)常温下在20mL0.1mol/LNa2CO3溶液中逐滴滴加40ml0.1mol/L盐酸溶液,溶液中含碳元素的三种微粒H2CO3、HCO

回答下列问题:
①各字母代表的粒子为b
②在同一溶液中,H2CO3、HCO
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______ 。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____ 。
③向NaCN溶液通入少量CO2反应的化学方程式是_______ 。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____ ,此时, =
=_____ 。
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
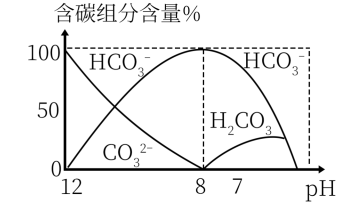
回答下列问题:
在同一溶液中H2CO3、 、
、
______ (填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____ ,溶液中各种离子( 除外)的物质的量浓度的大小关系为
除外)的物质的量浓度的大小关系为______ 。
③已知在25℃时, 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh= =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c( ):c(
):c( )=2:1时,溶液pH=
)=2:1时,溶液pH=______ 。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________ mol/L。
(1)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)
③向NaCN溶液通入少量CO2反应的化学方程式是
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
在同一溶液中H2CO3、
②当pH=7时,溶液中含碳元素的主要微粒为
③已知在25℃时,
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



