解答题-原理综合题 适中0.65 引用2 组卷311
(1)

(2)在
①该可逆反应达到平衡的标志为
A.四种物质分压之比等于计量系数之比 B.单位体积内分子总数不变
C.混合气体的平均相对分子质量不变 D.
②0~5min内,
③10min达平衡后,该温度下继续充入
(3)
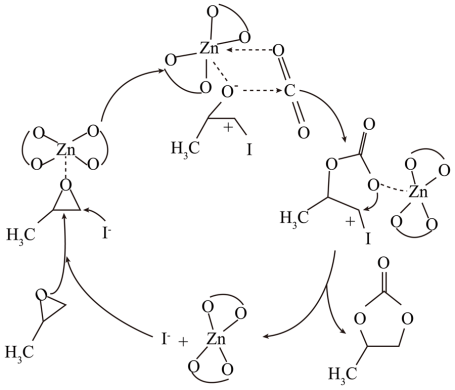
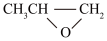 )在催化剂作用下生成(
)在催化剂作用下生成(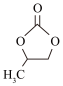 )的反应原理如图:
)的反应原理如图: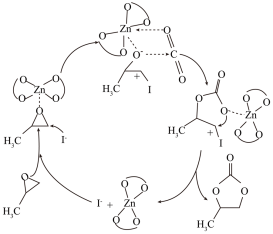
该反应的化学方程式为
21-22高三上·天津南开·阶段练习
知识点:根据△H=生成物的总能量之和-反应物的总能量之和进行计算化学平衡的移动及其影响因素化学平衡状态的判断方法化学平衡常数的有关计算 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
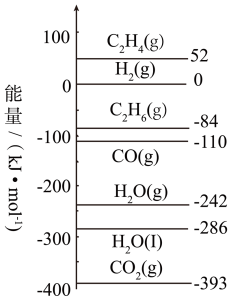
为了实现“碳达峰”和“碳中和”的目标,将 催化加氢合成低碳烯烃是解决温室效应和化工原料问题的有效途径。已知部分反应的热化学方程式如下:
催化加氢合成低碳烯烃是解决温室效应和化工原料问题的有效途径。已知部分反应的热化学方程式如下:
I.
Ⅱ.
Ⅲ.
回答下列问题:
(1)反应 的
的
_______  。
。
(2)120℃和有催化剂存在的条件下,恒容密闭容器中,反应Ⅱ达到平衡状态的标志是_____(填标号)。
(3)用碳化钼催化 和
和 重整制氢的反应原理如图所示。
重整制氢的反应原理如图所示。 发生的反应为
发生的反应为 ,则
,则 发生的反应为
发生的反应为_______ 。
②将 和
和 充入恒容密闭容器中发生反应:
充入恒容密闭容器中发生反应: ,在
,在 时,气体混合物中
时,气体混合物中 的物质的量分数
的物质的量分数 与反应时间
与反应时间 的关系如下表所示:
的关系如下表所示:
该反应中,正反应速率 ,逆反应速率
,逆反应速率 ,其中
,其中
 为速率常数,则
为速率常数,则
_______ (用 和
和 表示,其中
表示,其中 为用物质的量分数表示的平衡常数)。
为用物质的量分数表示的平衡常数)。 时,该反应的
时,该反应的
_______ (保留1位小数)。
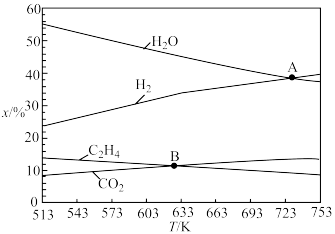
(4)在总压强恒定为 和
和 时,在容器体积可变的密闭容器中当只发生反应I时,平衡时各物质的物质的量百分数
时,在容器体积可变的密闭容器中当只发生反应I时,平衡时各物质的物质的量百分数 与温度
与温度 的关系如图所示。
的关系如图所示。 点时,
点时, 的平衡转化率为
的平衡转化率为_______ ;乙烯的分压为_______  。B点对应温度下反应I的压强平衡常数
。B点对应温度下反应I的压强平衡常数
_______  (保留1位小数)。
(保留1位小数)。
I.
Ⅱ.
Ⅲ.
回答下列问题:
(1)反应
(2)120℃和有催化剂存在的条件下,恒容密闭容器中,反应Ⅱ达到平衡状态的标志是_____(填标号)。
| A.单位时间内消耗 |
| B.混合气体的密度不再改变 |
| C.反应速率 |
| D.混合气体的平均相对分子质量不再改变 |
(3)用碳化钼催化
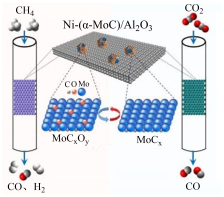
②将
| 0 | 10 | 20 | 30 | 40 | 50 | |
| 0 | 11 | 20 | 26 | 30 | 30 |
(4)在总压强恒定为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
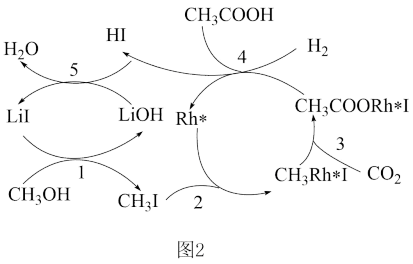
 )在催化剂作用下生成
)在催化剂作用下生成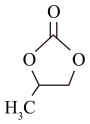 的反应原理如下:
的反应原理如下: