解答题-原理综合题 困难0.15 引用1 组卷876
研究C、N元素的单质及化合物的有效利用对工业生产有重要意义。请回答下列问题:
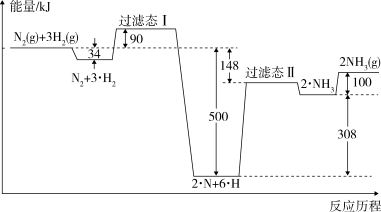
(1)合成氨反应的反应历程和能量变化如图所示: 2NH3(g) △H=
2NH3(g) △H=_______ 。
(2)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ∆H=-906kJ∙mol−1
4NO(g)+6H2O(g) ∆H=-906kJ∙mol−1
II.4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ∆H=-126kJ∙mol−1
2N2(g)+6H2O(g) ∆H=-126kJ∙mol−1
将固定比例NH3和O2的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图所示。_______ 。
②高于T2℃时,NO的产率降低的可能原因为_______ (填选项字母)。
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2 2CO+2H2,同时发生副反应b:CO2+H2
2CO+2H2,同时发生副反应b:CO2+H2 CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp= _______ (用含P和P0的计算式表示,已知分压=总压×物质的量分数)
(4)某恒温条件下,CaCO3(s) CaO(s)+CO2(g)的平衡常数K=1.5mol/L,在此温度下,CO2又有部分分解成CO,即2CO2(g)
CaO(s)+CO2(g)的平衡常数K=1.5mol/L,在此温度下,CO2又有部分分解成CO,即2CO2(g) 2CO(g)+O2(g),若将5molCaCO3装入1L真空容器中,当达到平衡时气体中O2的物质的量分数为20%,则此时CaO的物质的量为
2CO(g)+O2(g),若将5molCaCO3装入1L真空容器中,当达到平衡时气体中O2的物质的量分数为20%,则此时CaO的物质的量为_______ 。
(5)利用“合成气”合成甲醇后,脱水制得二甲醚。反应为:2CH3OH(g) CH3OCH3(g)+H2O(g)△H经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+
CH3OCH3(g)+H2O(g)△H经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+ 。其速率方程为:v正=k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、K逆为速率常数,且影响外因只有温度。
①反应达到平衡后,仅升高温度,k正增大的倍数_______ k逆增大的倍数(填“>”、“<”或“=”)。
②500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_______ (埴标号)
A. B.
B. C.
C. D.无法确定
D.无法确定
(1)合成氨反应的反应历程和能量变化如图所示:
(2)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I.4NH3(g)+5O2(g)
II.4NH3(g)+3O2(g)
将固定比例NH3和O2的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图所示。
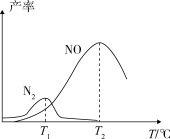
②高于T2℃时,NO的产率降低的可能原因为
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2
(4)某恒温条件下,CaCO3(s)
(5)利用“合成气”合成甲醇后,脱水制得二甲醚。反应为:2CH3OH(g)
①反应达到平衡后,仅升高温度,k正增大的倍数
②500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为
A.
21-22高三下·吉林长春·阶段练习
类题推荐
甲醇(CH3OH)是结构最为简单的饱和一元醇,又称“木醇”或“木精”。常用于制造甲醛和农药等。CO2催化加氢制甲醇,极具前景。发生的主要反应如下:
I. CO(g) +2H2(g) CH3OH(g) ΔH1= -90.6 kJ·mol-1
CH3OH(g) ΔH1= -90.6 kJ·mol-1
II. CO2(g) +H2(g) CO(g)+ H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+ H2O(g) ΔH2=+41.2 kJ·mol-1
III. CO2(g) +3H2(g) CH3OH(g)+ H2O(g) ΔH3
CH3OH(g)+ H2O(g) ΔH3
回答下列问题:
(1)△H3=___________ kJ·mol-1。
(2)对于反应II ,达平衡后,下列措施一定能提高H2转化率的是___________(填字母)。
(3)向盛有催化剂的刚性容器中通入n(CO2) : n(H2)=1 : 3混合气体,发生III反应。在T1 K和T2 K时,CO2的转化率(α)与时间(t)的关系如图所示。
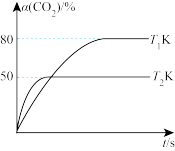
①温度:T1___________ (填“> ”或“<”)T2。
②T2K时,若平衡时体系的总压强为p0,则平衡常数Kp =____ (用含有p0的代数式表示)。
(4)已知二甲醚水解可生成甲醇,反应为CH3OCH3(g) +H2O(g) 2CH3OH(g) ΔH,其速率方程式为v正=k正·c(CH3OCH3)· c(H2O),v逆=k逆·c2 (CH3OH),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc= -A+
2CH3OH(g) ΔH,其速率方程式为v正=k正·c(CH3OCH3)· c(H2O),v逆=k逆·c2 (CH3OH),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc= -A+  B(Kc为化学平衡常数;T为热力学温度,单位为K,A、B为常数且均大于0)。
B(Kc为化学平衡常数;T为热力学温度,单位为K,A、B为常数且均大于0)。
①反应达到平衡后, =
= ____ (用含k正、k逆的代数式表示),若仅升高温度,k正增大的倍数____ (填“>”“<”或“=”,下同)k逆增大的倍数。
②已知某温度下,上述反应平衡常数Kc =0.5,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:v正 ____ v逆。
I. CO(g) +2H2(g)
II. CO2(g) +H2(g)
III. CO2(g) +3H2(g)
回答下列问题:
(1)△H3=
(2)对于反应II ,达平衡后,下列措施一定能提高H2转化率的是___________(填字母)。
| A.加入适量氢气 | B.使用高效催化剂 |
| C.增大n(CO2) | D.升高温度 |

①温度:T1
②T2K时,若平衡时体系的总压强为p0,则平衡常数Kp =
(4)已知二甲醚水解可生成甲醇,反应为CH3OCH3(g) +H2O(g)
①反应达到平衡后,
②已知某温度下,上述反应平衡常数Kc =0.5,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分的物质的量如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |
乙烯是一种重要的基本化工原料,乙烯的产量可以衡量一个国家的石油化工发展水平,研究工业制取乙烯有重要的意义。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) ΔH1
CH2=CH2(g)+4H2O(g) ΔH1
已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=_______
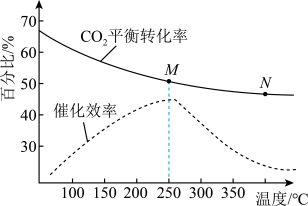
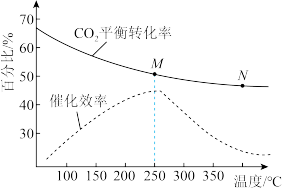
(2)在恒容密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______(不定项选择)。
II.工业用甲烷催化法制取乙烯:2CH4(g) C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
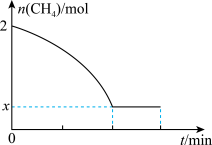
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为____ (用含x的代数式表示);若将温度升高,速率常数增大的倍数:k正_____ (填“>”“=”或“<”)k逆。
III.乙烷裂解制乙烯:C2H6(g) C2H4(g)+H2(g)。
C2H4(g)+H2(g)。
(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一恒压容器中发生反应。平衡时容器压强为P Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=_____ (用分压表示,分压=总压×物质的量分数)。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g)
已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=
(2)在恒容密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______(不定项选择)。

| A.为了提高乙烯的产率应尽可能选择低温 |
| B.生成乙烯的速率:v(M)可能小于v(N) |
| C.平衡常数:KM<KN |
| D.M点时的压强一定小于N点时的压强 |
II.工业用甲烷催化法制取乙烯:2CH4(g)

(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为
III.乙烷裂解制乙烯:C2H6(g)
(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一恒压容器中发生反应。平衡时容器压强为P Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=
乙烯是一种重要的基本化工原料,乙烯的产量可以衡量一个国家的石油化工发展水平,研究工业制取乙烯有重要的意义。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) ΔH1
CH2=CH2(g)+4H2O(g) ΔH1
已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=_______
(2)在密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______。
II.工业用甲烷催化法制取乙烯:2CH4(g)=C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:

(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为_______ (用含x的代数式表示);若将温度升高,速率常数增大的倍数:k正_______ (填“>”“=”或“<”)k逆。
III.乙烷裂解制乙烯:C2H6(g) C2H4(g)+H2(g)。
C2H4(g)+H2(g)。
(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一密闭容器中发生反应。平衡时容器压强为P0Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=_____ (用分压表示,分压=总压×物质的量分数)。
IV.电化学法还原二氧化碳制乙烯原理如下图所示。

(5)阴极电极反应式为:_______ ,电路中转移0.6mol电子,两极共收集气体_______ L(标准状况)。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g)
已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=
(2)在密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______。

| A.为了提高乙烯的产率应尽可能选择低温 |
| B.生成乙烯的速率:v(M)可能小于v(N) |
| C.平衡常数:KM<KN |
| D.M点时的压强一定小于N点时的压强 |
II.工业用甲烷催化法制取乙烯:2CH4(g)=C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:

(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为
III.乙烷裂解制乙烯:C2H6(g)
(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一密闭容器中发生反应。平衡时容器压强为P0Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=
IV.电化学法还原二氧化碳制乙烯原理如下图所示。

(5)阴极电极反应式为:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


