解答题-原理综合题 适中0.65 引用2 组卷321
近年来CO2变废为宝,改善环境是科学研究的重要课题,对于实现废气资源的再利用及碳循环经济技术的发展都具有重要意义。
I.已知CO2、C2H6为原料合成C2H4涉及的主要反应如下:
①C2H6(g) CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1
CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1
②C2H4(g)+H2(g) C2H6(g) △H2=-136 kJ·mol-1
C2H6(g) △H2=-136 kJ·mol-1
③H2(g)+CO2(g) H2O(g)+CO(g) △H3=+41 kJ·mol-1
H2O(g)+CO(g) △H3=+41 kJ·mol-1
④CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) △H4
C2H4(g)+H2O(g)+CO(g) △H4
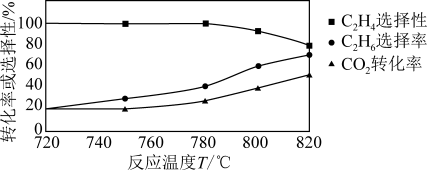
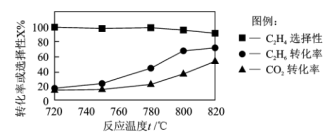
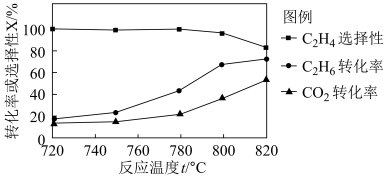
(1)△H4=_____ ,0.1MPa 时向密闭容器中充入CO2和C2H6,发生反应④,温度对催化剂K- Fe-Mn/Si 性能的影响如图:
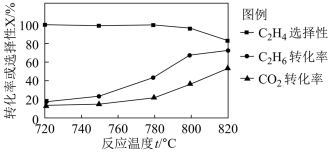
工业生产综合各方面的因素,根据图中的信息判断反应的最佳温度是______ °C。
(2)在800°C时,n(CO2):n(C2H6)=1: 3,充入一定体积的密闭容器中,在有催化剂存在的条件下,发生反应④,初始压强为p0,一段时间后达到平衡,产物的总物质的量与剩余反应物的总物质的量相等,则该温度下反应的平衡常数Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用最简分式表示)。
II.CO2和H2制备CH3OH,可实现CO2的资源化利用,涉及的反应如下:
主反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H <0
CH3OH(g)+H2O(g) △H <0
副反应: CO2(g)+H2(g) CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0
将反应物混合气体按进料比n(CO2): n(H2)=1: 3通入反应装置中,选择合适的催化剂,发生上述反应。
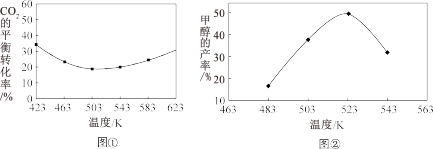
(3)不同温度下,CO2的平衡转化率如图①所示,温度高于503K时,CO2 的平衡转化率随温度的升高而增大的原因是___________ 。 实际生产中,保持压强不变,相同反应时间内不同温度下CH3OH的产率如图②所示,由图可知,523K时CH3OH的产率最大,可能的原因是___________ 。
III.捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。
(4)已知: NH3·H2O的Kb=1.7 ×10-5, H2CO3的Ka1=4.3 ×10-7, Ka2 =5.6 ×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至20°C后用氨水吸收过量的CO2。吸收反应的化学反应方程式为___________ ,所得溶液离子浓度由大到小的顺序是___________ (不考虑二氧化碳的溶解)。
I.已知CO2、C2H6为原料合成C2H4涉及的主要反应如下:
①C2H6(g)
②C2H4(g)+H2(g)
③H2(g)+CO2(g)
④CO2(g)+C2H6(g)
(1)△H4=

工业生产综合各方面的因素,根据图中的信息判断反应的最佳温度是
(2)在800°C时,n(CO2):n(C2H6)=1: 3,充入一定体积的密闭容器中,在有催化剂存在的条件下,发生反应④,初始压强为p0,一段时间后达到平衡,产物的总物质的量与剩余反应物的总物质的量相等,则该温度下反应的平衡常数Kp=
II.CO2和H2制备CH3OH,可实现CO2的资源化利用,涉及的反应如下:
主反应: CO2(g)+3H2(g)
副反应: CO2(g)+H2(g)
将反应物混合气体按进料比n(CO2): n(H2)=1: 3通入反应装置中,选择合适的催化剂,发生上述反应。
(3)不同温度下,CO2的平衡转化率如图①所示,温度高于503K时,CO2 的平衡转化率随温度的升高而增大的原因是

III.捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。
(4)已知: NH3·H2O的Kb=1.7 ×10-5, H2CO3的Ka1=4.3 ×10-7, Ka2 =5.6 ×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至20°C后用氨水吸收过量的CO2。吸收反应的化学反应方程式为
21-22高三上·福建福州·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网