解答题-原理综合题 适中0.65 引用3 组卷204
不同的化学反应具有不同的反应热,人们可以通过多种方法获得反应热的数据,通常用实验进行测定,也可以进行理论推算。
Ⅰ.在科学研究中,科学家常用量热计来测量反应热。我校某化学兴趣小组的同学欲测定盐酸与氢氧化钠溶液反应的反应热,则:
(1)测定中和热的装置如图1所示。
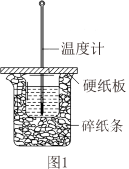
①从实验装置上看,图中尚缺少的一种仪器是____ 。
②做一次完整的中和热测定实验,温度计需使用____ 次。
③现用50mL0.5mol/L的稀盐酸与50mL0.55mol/L氢氧化钠溶液反应测定,以下操作可能会导致测得的中和热数值偏大的是____ 。
A.实验装置保温、隔热效果差
B.量取稀盐酸的体积时仰视读数
C.分多次把氢氧化钠溶液倒入盛有盐酸的小烧杯中
D.用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验
(2)在25mL1.00mol/LHCl溶液中逐滴加入未知浓度NaOH溶液VmL,将溶液搅拌均匀后,在保温隔热的条件下测量并记录混合溶液的温度,实验结果如图2所示。
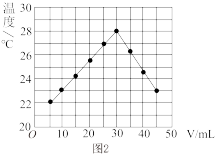
①做该实验时环境温度____ 22℃(填“<”、“>”或“=”)。
②NaOH溶液的物质的量浓度约为____ (保留小数点后两位)。
Ⅱ.并不是所有反应的反应热均可通过实验直接测定。
(3)已知:由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。部分化学键键能数据如表:
反应N2(g)+3H2(g) 2NH3(g)ΔH=akJ/mol,根据所列键能数据计算a=
2NH3(g)ΔH=akJ/mol,根据所列键能数据计算a=____ kJ/mol。
(4)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+akJ/mol
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)ΔH=-bkJ/mol
O2(g)=CO2(g)+2H2(g)ΔH=-bkJ/mol
又知③H2O(g)=H2O(l)ΔH=-ckJ/mol
则甲醇蒸气燃烧的热化学方程式:____ (ΔH用a、b、c表示)。
Ⅰ.在科学研究中,科学家常用量热计来测量反应热。我校某化学兴趣小组的同学欲测定盐酸与氢氧化钠溶液反应的反应热,则:
(1)测定中和热的装置如图1所示。
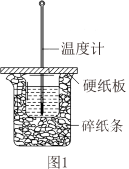
①从实验装置上看,图中尚缺少的一种仪器是
②做一次完整的中和热测定实验,温度计需使用
③现用50mL0.5mol/L的稀盐酸与50mL0.55mol/L氢氧化钠溶液反应测定,以下操作可能会导致测得的中和热数值偏大的是
A.实验装置保温、隔热效果差
B.量取稀盐酸的体积时仰视读数
C.分多次把氢氧化钠溶液倒入盛有盐酸的小烧杯中
D.用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验
(2)在25mL1.00mol/LHCl溶液中逐滴加入未知浓度NaOH溶液VmL,将溶液搅拌均匀后,在保温隔热的条件下测量并记录混合溶液的温度,实验结果如图2所示。

①做该实验时环境温度
②NaOH溶液的物质的量浓度约为
Ⅱ.并不是所有反应的反应热均可通过实验直接测定。
(3)已知:由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。部分化学键键能数据如表:
| 化学键 | H—H | N—H | N≡N |
| 键能(kJ/mol) | 436 | 391 | 945 |
(4)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+akJ/mol
②CH3OH(g)+
又知③H2O(g)=H2O(l)ΔH=-ckJ/mol
则甲醇蒸气燃烧的热化学方程式:
21-22高三上·黑龙江·期中
类题推荐
不同的化学反应具有不同的反应热,人们可以通过多种方法获得反应热的数据,通常用实验进行测定,也可以进行理论推算。
I.在科学研究中,科学家常用量热计来测量反应热。我校某化学兴趣小组的同学欲测定硫酸与氢氧化钠溶液反应的反应热,则:
(1)用98%浓硫酸(密度1.84 g/cm3)配制浓度为0.5 mol/L稀硫酸450 mL
①所需浓硫酸的体积为_________ mL;
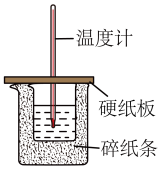
②选用的主要仪器有:烧杯、量筒、______ 、______ 、_______ ;
(2)测定中和热的装置如图所示。
①从实验装置上看,图中尚缺少的一种仪器是_______ ;
②做一次完整的中和热测定实验,温度计需使用____ 次;
③现用25 mL 0.5 mol/L的稀硫酸与50 mL 0.55mol/L氢氧化钠溶液反应测定,以下操作可能会导致测得的中和热数值偏大的是( )
A.实验装置保温、隔热效果差
B.量取稀硫酸的体积时仰视读数
C.分多次把氢氧化钠溶液倒入盛有硫酸的小烧杯中
II.并不是所有反应的反应热均可通过实验直接测定。
(1)已知:由气态基态原子形成1 mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。部分化学键键能数据如下表:
反应N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,试根据表中所列键能数据估算a=
2NH3(g) ΔH=a kJ·mol-1,试根据表中所列键能数据估算a=__________ 。
(2)依据盖斯定律可以对某些反应的焓变进行推算。已知:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) ΔH1=-24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) ΔH2=-47.1kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ΔH3=+640.5kJ/mol
请写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_______________ 。
I.在科学研究中,科学家常用量热计来测量反应热。我校某化学兴趣小组的同学欲测定硫酸与氢氧化钠溶液反应的反应热,则:
(1)用98%浓硫酸(密度1.84 g/cm3)配制浓度为0.5 mol/L稀硫酸450 mL
①所需浓硫酸的体积为

②选用的主要仪器有:烧杯、量筒、
(2)测定中和热的装置如图所示。
①从实验装置上看,图中尚缺少的一种仪器是
②做一次完整的中和热测定实验,温度计需使用
③现用25 mL 0.5 mol/L的稀硫酸与50 mL 0.55mol/L氢氧化钠溶液反应测定,以下操作可能会导致测得的中和热数值偏大的是
A.实验装置保温、隔热效果差
B.量取稀硫酸的体积时仰视读数
C.分多次把氢氧化钠溶液倒入盛有硫酸的小烧杯中
II.并不是所有反应的反应热均可通过实验直接测定。
(1)已知:由气态基态原子形成1 mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。部分化学键键能数据如下表:
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ/mol) | 436 | 391 | 945 |
反应N2(g)+3H2(g)
 2NH3(g) ΔH=a kJ·mol-1,试根据表中所列键能数据估算a=
2NH3(g) ΔH=a kJ·mol-1,试根据表中所列键能数据估算a=(2)依据盖斯定律可以对某些反应的焓变进行推算。已知:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) ΔH1=-24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) ΔH2=-47.1kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ΔH3=+640.5kJ/mol
请写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。实验数据如下表。
(1)①从实验装置看,图中还缺少的一种玻璃仪器是___________ 。在实验过程中,该仪器搅拌的正确操作方法是:___________ 。
②近似认为0.55 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1.则中和热ΔH=___________ (取小数点后一位)。中和热测定时采用稍过量的氢氧化钠的原因:___________ 。
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是___________ (填字母)。
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较
会___________ (填“偏大”“偏小”或“无影响”)。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:___________ 。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
则N2(g)+3H2(g)═2NH3(g) △H=___________ kJ•mol-1(用小写字母表示)。
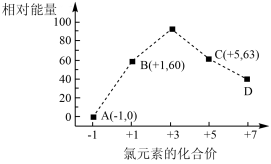
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=___________ kJ•mol-1。
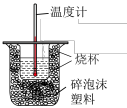
起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | |||
HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)①从实验装置看,图中还缺少的一种玻璃仪器是
②近似认为0.55 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1.则中和热ΔH=
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较
会
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
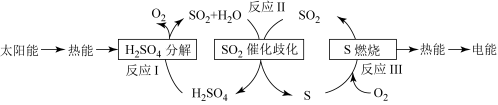
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | a | b | c |
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO
50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。______ 。
②中和热测定时采用稍过量的氢氧化钠的原因:______ 。
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是______ (填字母)。
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较会______ (填“偏大”“偏小”或“无影响”)。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:_____ 。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
则N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=______ kJ•mol-1(用小写字母表示)。
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=______ kJ•mol-1。

②中和热测定时采用稍过量的氢氧化钠的原因:
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较会
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:

反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | a | b | c |
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


