解答题-结构与性质 适中0.65 引用1 组卷101
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。
请根据以上情况,回答下列问题:
(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_______ 。
(2)B的氢化物分子的立体构型是_______ 。其中心原子采取_______ 杂化。
(3)E的核外电子排布式是_______ ,ECl3形成的配合物的化学式_______ 。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是_______ 。
(5)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是_______ ,SO 的空间构型为
的空间构型为_______ 。
(6)氨缩脲(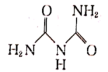 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为_______ ,σ 键与π键的数目之比为_______ 。氨缩脲与胆矾溶液反应得到如图所示的紫色物质,1 mol紫色物质中含配位键的数目为_______ 。
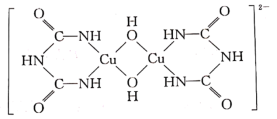
请根据以上情况,回答下列问题:
(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物分子的立体构型是
(3)E的核外电子排布式是
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
(5)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是
(6)氨缩脲(
 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为
21-22高二下·重庆渝北·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


