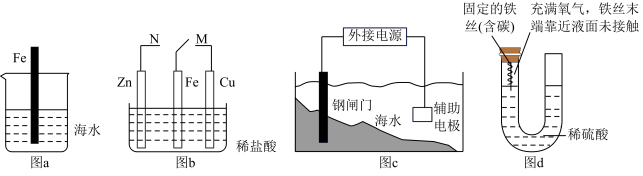
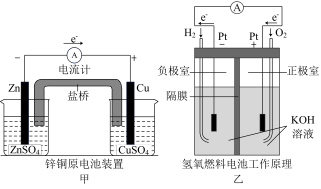
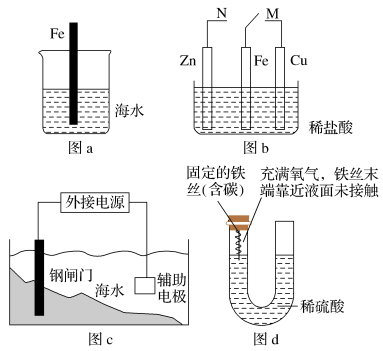
解答题-原理综合题 适中0.65 引用1 组卷110
利用氧化还原反应可以解决很多实际问题:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O
(1)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol/L盐桥中装有饱和溶液。K2SO4回答下列问题:
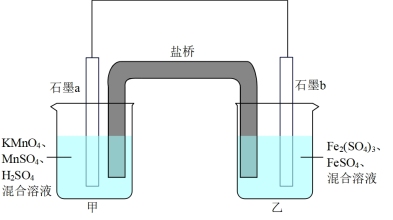
①发生氧化反应的烧杯是_______ (填“甲”或“乙”)。
②外电路的电流方向为:从_______ 。(用“a”“b”表示)
③电池工作时,盐桥中的SO 移向
移向_______ (填“甲”或“乙”)烧杯。
④甲烧杯中发生的电极反应_______ 。
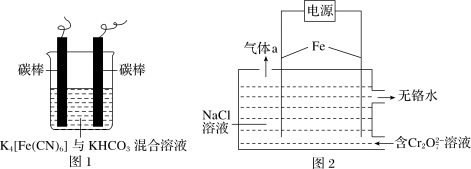
(2)工业上处理含Cr2O 的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。
的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。
①电解时的电极反应:阳极_______ ,阴极_______ 。
②Cr2O 转变成Cr3+的离子反应方程式:
转变成Cr3+的离子反应方程式:_______ 。
(3)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。
①放电时负极的电极反应为:_______ ;放电时电解质溶液的pH逐渐_______ ;(填“增大”或“减小”)
②充电时有CH3OH生成的电极为_______ 极; 填“阴极”或阳极
填“阴极”或阳极 充电时每生成1 molCH3OH转移
充电时每生成1 molCH3OH转移_______ mol电子
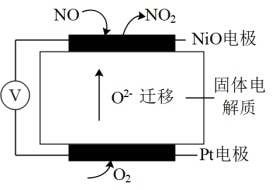
(4)通过NOx传感器可监测NOx的含量,工作原理示意图如图所示,Pt电极上发生的是_______ 反应(填“氧化”或“还原”)。写出NiO电极的电极反应式:_______ 。
(1)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol/L盐桥中装有饱和溶液。K2SO4回答下列问题:

①发生氧化反应的烧杯是
②外电路的电流方向为:从
③电池工作时,盐桥中的SO
④甲烧杯中发生的电极反应
(2)工业上处理含Cr2O
①电解时的电极反应:阳极
②Cr2O
(3)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。
①放电时负极的电极反应为:
②充电时有CH3OH生成的电极为
(4)通过NOx传感器可监测NOx的含量,工作原理示意图如图所示,Pt电极上发生的是

21-22高二下·宁夏石嘴山·阶段练习
类题推荐
I.某同学利用反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图所示的原电池,盐桥中装有饱和K2SO4溶液。当电池工作时,回答:
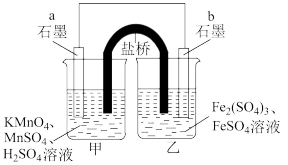
(1)b电极上发生的反应是___________ 反应;
(2)外电路电子在电极a、b间的流向是___________ 。
(3)盐桥中的SO 移向
移向___________ 烧杯。
(4)a电极上发生的反应为___________ 。
II.某科研小组设计利用甲醇(CH3OH)燃料电池(酸性溶液作离子导体),模拟工业电镀、精炼和海水淡化的装置如下。
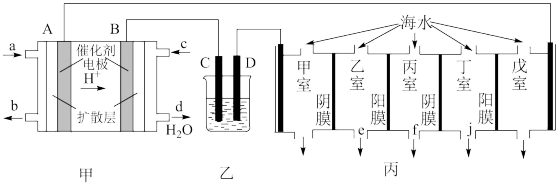
(5)甲装置中c口通入的气体是___________ ,A电极的电极反应式为___________ 。
(6)乙装置用来模拟电解精炼和电镀。
①若用于粗铜的精炼,装置中电极C是___________ (填“粗铜”或“纯铜”),工作一段时间后,电解质CuSO4溶液的浓度将___________ (填“增大”“减小”或“不变”)。
②若用于电镀金属银,则电镀液宜使用___________ 溶液,镀件是___________ (选填“C”或“D”)。
(7)电渗析法是海水淡化的常用方法,某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图丙所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。
①淡化过程中在___________ 室中易形成水垢,该室中除发生电极反应外,还发生形成水垢的离子反应有:Mg2+ + 2OH- =Mg(OH)2↓和___________ 。
②产生淡水的出水口为___________ (选填“e”、“f”、“ j”)。

(1)b电极上发生的反应是
(2)外电路电子在电极a、b间的流向是
(3)盐桥中的SO
(4)a电极上发生的反应为
II.某科研小组设计利用甲醇(CH3OH)燃料电池(酸性溶液作离子导体),模拟工业电镀、精炼和海水淡化的装置如下。

(5)甲装置中c口通入的气体是
(6)乙装置用来模拟电解精炼和电镀。
①若用于粗铜的精炼,装置中电极C是
②若用于电镀金属银,则电镀液宜使用
(7)电渗析法是海水淡化的常用方法,某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图丙所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。
| 离子 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO | HCO |
| 含量/mg·L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
①淡化过程中在
②产生淡水的出水口为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网