解答题-原理综合题 适中0.65 引用1 组卷105
完成下列填空
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=−534 kJ∙mol−1
H2O2(l)=H2O(l)+ O2(g) ΔH=−98 kJ∙mol−1
O2(g) ΔH=−98 kJ∙mol−1
H2O(l)=H2O(g) ΔH=44 kJ∙mol−1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式:_______ 。
(2)反应的自发性由焓变和熵变两个因素决定。N2(g)+O2(g)=2NO(g),已知N≡N的键能为946 kJ∙mol−1,O=O键的键能为498 kJ∙mol−1,N≡O的键能为630 kJ∙mol−1;该反应的ΔH=_______ ,其反应自发的原因是_______ 。
(3)以纯铜作阴极,以石墨作阳极,电解某浓度的硫酸铜溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入16.0gCuO固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)_______ L。
(4)科学家设计利用电化学原理回收CO2达到减排的目的,实验装置如图所示。
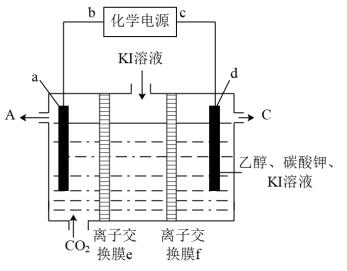
已知在碱性条件下,卤素单质可以和乙醇反应。假设理想状态下,该装置能将a电极的CO2全部转化成HCOO-。
①则b为_______ 极(填“正”或“负”),a电极的电极反应式为_______ 。
②标准状况下,当有4mol电子转移时,回收的 CO2为_______ L。
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=−534 kJ∙mol−1
H2O2(l)=H2O(l)+
H2O(l)=H2O(g) ΔH=44 kJ∙mol−1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式:
(2)反应的自发性由焓变和熵变两个因素决定。N2(g)+O2(g)=2NO(g),已知N≡N的键能为946 kJ∙mol−1,O=O键的键能为498 kJ∙mol−1,N≡O的键能为630 kJ∙mol−1;该反应的ΔH=
(3)以纯铜作阴极,以石墨作阳极,电解某浓度的硫酸铜溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入16.0gCuO固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)
(4)科学家设计利用电化学原理回收CO2达到减排的目的,实验装置如图所示。

已知在碱性条件下,卤素单质可以和乙醇反应。假设理想状态下,该装置能将a电极的CO2全部转化成HCOO-。
①则b为
②标准状况下,当有4mol电子转移时,回收的 CO2为
21-22高二下·四川成都·阶段练习
类题推荐
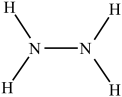
液态肼(N2H4)是一种高能燃料,在工业生产中用途广泛,其结构如图所示:
(1)N2H4可在O2中燃烧生成N2和水蒸气,已知:16g肼完全反应放出热量为267kJ,则该反应的热化学方程式为_____ 。部分共价键键能如表所示,则N-N的键能为_____ kJ/mol。
(2)肼—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
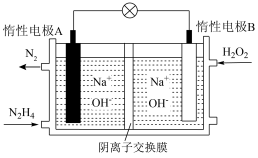
该电池的B极区发生_____ (填“氧化反应”或“还原反应”),负极的电极反应为_____ ,电池工作过程中,若A极区产生11.2L(标况下)N2,则转移的电子数目为_____ 。此时,左侧溶液的pH_____ ,右侧溶液的pH_____ (填“变大”“变小”“不变”)。
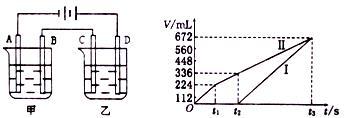
(3)向某温度恒定、体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。

请回答下列问题:
①密闭容器的容积为_____ ,物质B的起始浓度是_____ 。
②若t1=15,则0~t1s内以C物质浓度变化表示的反应速率v(C)=_____ 。t=7.5时,c(C)_____ 0.08mol/L(填“>”、“=”或“<”);③该反应的化学方程式为_____ ,A的平衡转化率为_____ 。

(1)N2H4可在O2中燃烧生成N2和水蒸气,已知:16g肼完全反应放出热量为267kJ,则该反应的热化学方程式为
| N-H | O=O | N≡N | H-O | |
| 键能(kJ/mol) | 391 | 498 | 936 | 463 |

该电池的B极区发生
(3)向某温度恒定、体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。

请回答下列问题:
①密闭容器的容积为
②若t1=15,则0~t1s内以C物质浓度变化表示的反应速率v(C)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网