解答题-实验探究题 较易0.85 引用1 组卷158
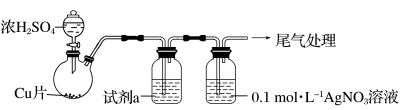
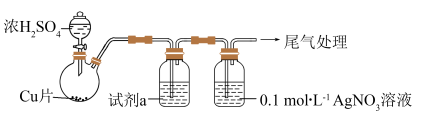
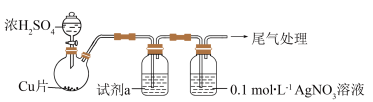
化学小组实验探究SO2与AgNO3溶液的反应。用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。(已知:浓硫酸沸点338°C,酒精灯外焰温度400-500°C)
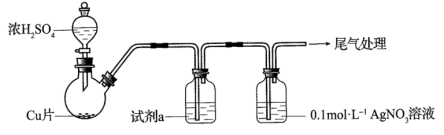
(1)浓H2SO4与Cu反应的化学方程式是_______ 。
(2)试剂a是饱和NaHSO3溶液,目的是为了除去SO2中混有的_______ 杂质。
(3)①白色沉淀B为Ag2SO3,写出生成Ag2SO3的离子方程式_______ 。(反应a)
②无色溶液A放置一段时间后,生成含Ag的灰黑色粉末,写出反应的离子方程式_______ 。(反应b)按照氧化还原思想分析,产物中应该含有SO ,实验证明所需试剂为
,实验证明所需试剂为_______ 。
③根据以上描述,判断反应速率:反应a_______ 反应b(填><或=)

(1)浓H2SO4与Cu反应的化学方程式是
(2)试剂a是饱和NaHSO3溶液,目的是为了除去SO2中混有的
(3)①白色沉淀B为Ag2SO3,写出生成Ag2SO3的离子方程式
②无色溶液A放置一段时间后,生成含Ag的灰黑色粉末,写出反应的离子方程式
③根据以上描述,判断反应速率:反应a
20-21高一下·北京朝阳·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网