解答题-原理综合题 适中0.65 引用1 组卷46
“十四五”规划明确了“碳达峰、碳中和”工作的定位。某科研机构想利用 和
和 合成燃料。已知:
合成燃料。已知:
①

②

③

④

(1) 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
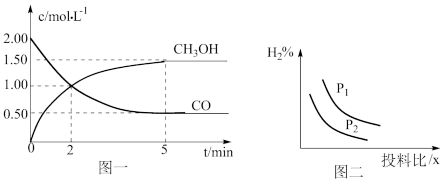
(2)某温度下,向一恒容密闭容器中按照 投料,在一定条件下发生反应:
投料,在一定条件下发生反应: ,测得
,测得 和
和 的物质的量浓度随时间的变化如图所示。
的物质的量浓度随时间的变化如图所示。
①反应达到A点时,v正___________ (填“>”、“<”或“=”)v逆;0~3min内,
___________  ,该温度下的平衡常数K=
,该温度下的平衡常数K=___________  。
。
②关于该反应,下列说法错误的是___________ (填标号)。
a.使用催化剂可以提高反应物的转化率
b.在原容器中再充入 ,可以提高
,可以提高 的转化率
的转化率
c.反应达到平衡时,每断裂3molC—H键的同时生成3molH—H键
d.反应达到平衡后,再按照原来的投料比加入反应物,再次达到平衡后, 的产率增大
的产率增大
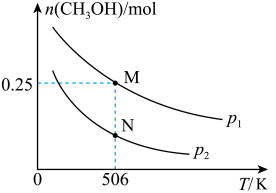
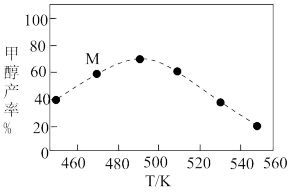
③将上述反应改为在恒压条件下进行,测得相同时间内、不同温度下甲醇的产率如图中虚线所示。温度为470K时,图中M点的浓度商Q___________ (填“>”、“<”或“=”)平衡常数K。490K之后,甲醇产率下降的原因是___________ 。
①
②
③
④
(1)
(2)某温度下,向一恒容密闭容器中按照

①反应达到A点时,v正
②关于该反应,下列说法错误的是
a.使用催化剂可以提高反应物的转化率
b.在原容器中再充入
c.反应达到平衡时,每断裂3molC—H键的同时生成3molH—H键
d.反应达到平衡后,再按照原来的投料比加入反应物,再次达到平衡后,
③将上述反应改为在恒压条件下进行,测得相同时间内、不同温度下甲醇的产率如图中虚线所示。温度为470K时,图中M点的浓度商Q

21-22高二下·湖北·阶段练习
类题推荐
甲醇是重要的化工原料,可以使用多种方法制备甲醇。科学家利用CO或 和
和 都能合成甲醇,同时有利于减少二氧化碳的排放。已知在一定温度和压强下,发生如下反应:
都能合成甲醇,同时有利于减少二氧化碳的排放。已知在一定温度和压强下,发生如下反应:




(1)则反应

_______ 。
(2)利用反应 合成甲醇。T℃时向固定容积的密闭容器中充入CO、H2,反应到t时刻测得各组分的浓度如下:
合成甲醇。T℃时向固定容积的密闭容器中充入CO、H2,反应到t时刻测得各组分的浓度如下:
如果该反应的平衡常数 ,比较t时刻正、逆反应速率的大小:v正
,比较t时刻正、逆反应速率的大小:v正_______ v逆(填“大于”“小于”或“等于”)。
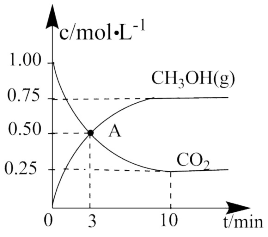
(3)向1L的恒容密闭容器中按物质的量之比1∶2充入一定量CO和 ,在催化剂的作用下合成甲醇,测得平衡时混合物中
,在催化剂的作用下合成甲醇,测得平衡时混合物中 的体积分数在不同压强下随温度的变化如图甲所示。(已知
的体积分数在不同压强下随温度的变化如图甲所示。(已知 时最初充入1mol CO。)
时最初充入1mol CO。)

①下列说法正确的是_______ 。
A.该反应的
B.反应速率:
C.A、B、C的平衡常数大小:
D.在压强为 下,反应经过5min达到B点的平衡状态,则
下,反应经过5min达到B点的平衡状态,则
②D点时反应 的平衡常数K=
的平衡常数K=_______ 。
(4)T℃时向恒容密闭容器中充入 和
和 ,发生反应
,发生反应 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示:

①c点转化率比a点低的原因是_______ 。
②下列措施有利于提高 转化为
转化为 的平衡转化率的有
的平衡转化率的有_______ 。
A.恒容条件下充入稀有气体He
B.在达到平衡后的体系中移出部分甲醇
C.保持反应容器的体积不变,平衡时再按照原投料比投入一定量的原料
D.选择催化效率更高的催化剂
③维持温度 足够长时间,则
足够长时间,则 的转化率
的转化率_______ a(填“大于”“小于”或“等于”)。
(1)则反应
(2)利用反应
| 物质 | ||||
| 浓度 | 0.60 | 0.40 | 1.20 | 1.20 |
(3)向1L的恒容密闭容器中按物质的量之比1∶2充入一定量CO和

①下列说法正确的是
A.该反应的
B.反应速率:
C.A、B、C的平衡常数大小:
D.在压强为
②D点时反应
(4)T℃时向恒容密闭容器中充入

①c点转化率比a点低的原因是
②下列措施有利于提高
A.恒容条件下充入稀有气体He
B.在达到平衡后的体系中移出部分甲醇
C.保持反应容器的体积不变,平衡时再按照原投料比投入一定量的原料
D.选择催化效率更高的催化剂
③维持温度
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(g) ΔH
CH3OH(g) ΔH