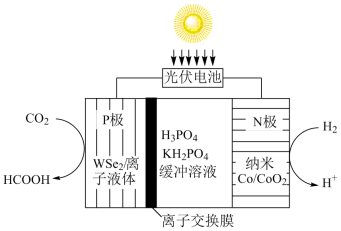
解答题-原理综合题 适中0.65 引用3 组卷577
研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。
(1)减少碳排放的方法有很多, 转化成有机化合物可有效实现碳循环,如下反应:
转化成有机化合物可有效实现碳循环,如下反应:
a.
b.
c.
上述反应中原子利用率最高的是_______ (填编号)。
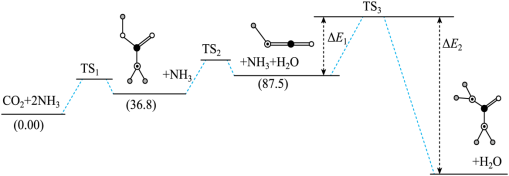
(2) 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:
副反应:
①已知 ,则
,则 燃烧的热化学方程式
燃烧的热化学方程式
_______ 。
②加氢合成甲烷时,通常控制温度为 左右,其可能的原因是
左右,其可能的原因是_______ 。
(3)在一定条件下,向某恒容密闭容器中充入 和
和 ,发生反应
,发生反应 。
。
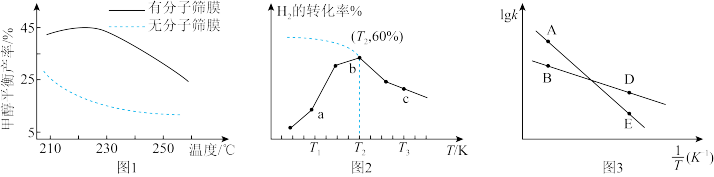
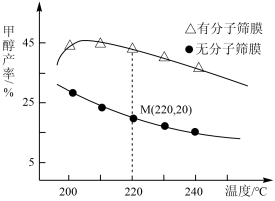
①温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响如图1所示:则
_______ 0(填“>”、“<”或“=”);其他条件不变,甲醇的平衡产率总是高于没有分子筛膜,其原因是_______ 。
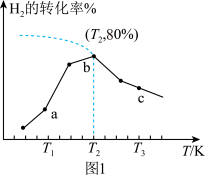
②测得在相同时间内,不同温度下 的转化率如图2所示,
的转化率如图2所示,
_______  (填“>”、“<”或“=”);
(填“>”、“<”或“=”); 时,若起始压强为
时,若起始压强为 ,计算
,计算
_______  (
( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
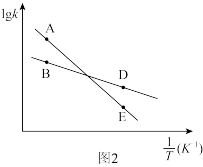
③已知速率方程 ,
, 、
、 是速率常数,只受温度影响。图3表示速率常数的对数
是速率常数,只受温度影响。图3表示速率常数的对数 、
、 与温度的倒数
与温度的倒数 之间的关系,A、B、D、E分别代表图2中a点、c点的速率常数,则点
之间的关系,A、B、D、E分别代表图2中a点、c点的速率常数,则点_______ 表示c点的 。
。
(1)减少碳排放的方法有很多,
a.
b.
c.
上述反应中原子利用率最高的是
(2)
主反应:
副反应:
①已知
②加氢合成甲烷时,通常控制温度为
(3)在一定条件下,向某恒容密闭容器中充入

①温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响如图1所示:则
②测得在相同时间内,不同温度下
③已知速率方程
2022·山东聊城·一模
类题推荐
二氧化碳( )的排放不断增加,已经对环境造成了巨大影响。将
)的排放不断增加,已经对环境造成了巨大影响。将 选择性加氢为甲醇,这不仅可以有效减少
选择性加氢为甲醇,这不仅可以有效减少 排放,而且还可以生产增值的化学物质和燃料。已知甲醇制备的有关化学反应以及在不同温度下,恒容的密闭容器中的化学反应平衡常数如表所示:
排放,而且还可以生产增值的化学物质和燃料。已知甲醇制备的有关化学反应以及在不同温度下,恒容的密闭容器中的化学反应平衡常数如表所示:
(1)写出反应③: 与
与 生成
生成 和
和 的热化学反应方程式:
的热化学反应方程式:_______ 。
(2)对于反应③,起始充入0.4 mol 和0.1 mol
和0.1 mol  ,在温度和容积不变时,能说明该反应已达平衡状态的是_______(填字母)。
,在温度和容积不变时,能说明该反应已达平衡状态的是_______(填字母)。
(3)在500℃,恒容容器中测得反应③在某时刻, 、
、 、
、 、
、 的浓度( mol·L
的浓度( mol·L )分别为0.1、0.5、0.3、0.15,则此时
)分别为0.1、0.5、0.3、0.15,则此时
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)一定条件下,将2 mol 和4 mol
和4 mol  充入密闭容器中,仅发生反应③制取甲醇,
充入密闭容器中,仅发生反应③制取甲醇, 的平衡转化率与温度、平衡总压强的关系如图1所示。
的平衡转化率与温度、平衡总压强的关系如图1所示。
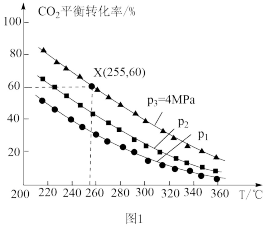
① 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ 。
②255℃时,该反应的压强平衡常数
_______ (MPa) (
( 为以分压表示的平衡常数,分压=总压×物质的量分数;计算结果保留1位小数)。
为以分压表示的平衡常数,分压=总压×物质的量分数;计算结果保留1位小数)。
(5)恒压下, 和
和 的起始物质的量比为1∶3时,反应
的起始物质的量比为1∶3时,反应 在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图2所示,其中分子筛膜能选择性分离出
在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图2所示,其中分子筛膜能选择性分离出 。
。

①无分子筛膜时,甲醇平衡产率随温度升高而降低的原因为_______ 。
②P点甲醇产率高于T点的原因为_______ 。
| 化学反应 | 平衡常数 | |
| 500℃ | 800℃ | |
| ① | 2.5 | 0.15 |
| ② | 1.0 | 2.50 |
(2)对于反应③,起始充入0.4 mol
| A.容器内 |
| B. |
| C. |
| D.容器内的密度保持不变 |
(4)一定条件下,将2 mol

①
②255℃时,该反应的压强平衡常数
(5)恒压下,

①无分子筛膜时,甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网