解答题-工业流程题 较难0.4 引用4 组卷850
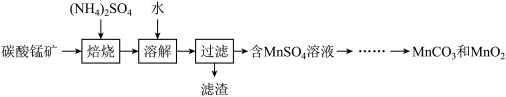
实验室以碳酸锰矿(含MnCO3及少量Fe、Al、Si等氧化物)为原料制高纯MnCO3和MnO2的流程如下:

(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:______ 。
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4) ,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4)
,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4) 与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量
与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量___________ (写出计算过程)。
(3)将过滤后所得溶液净化后可得MnSO4溶液。
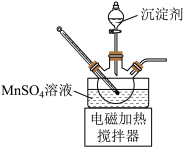
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。
a.不使用Na2CO3溶液的原因是___________ 。
b.不使用NH4HCO3溶液的原因是___________ 。
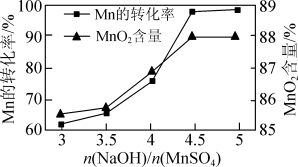
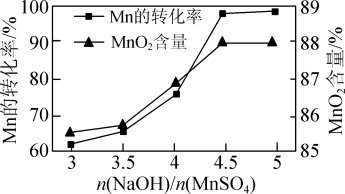
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{ }与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
}与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,___________ ,得到纯净的MnO2(实验中可使用的试剂是1.0mol·L-1 NaOH溶液、1.0mol·L-1 H2SO4溶液、1.0mol·L-1 BaCl2溶液)。

(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4)
(3)将过滤后所得溶液净化后可得MnSO4溶液。
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。

a.不使用Na2CO3溶液的原因是
b.不使用NH4HCO3溶液的原因是
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{

2022·江苏·一模
类题推荐
以MnO2粉(含少量Fe3O4、CaO、MgO等杂质)和MnS(溶于酸,不溶于水)为原料制备MnSO4·H2O的过程如下:
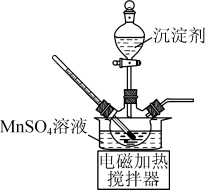
(1)反应:将一定量MnO2粉和稀硫酸加入到如图所示实验装置的三颈烧瓶中,加热到90℃后开始加入MnS,并不断搅拌,充分反应。
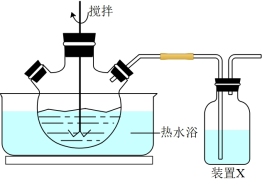
①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为_______ 。
②装置X中是NaOH溶液,作用是_______ 。
(2)除杂。查阅资料可知:
Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11,Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
①将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。
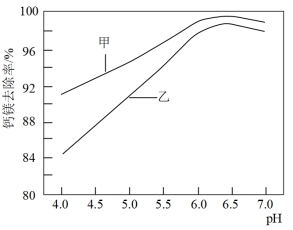
Mg2+去除率曲线为_______ (填写“甲”或“乙”)。随pH减小,钙镁去除率下降的原因是_______ 。
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案:_______ ,控制温度在80~90℃之间蒸发结晶至有大量晶体出现,趁热过滤,用80~90℃的蒸馏水洗涤2~3次,干燥。(可选用的试剂:H2O2溶液、MnCO3固体、Na2CO3固体、蒸馏水等)。
(3)测定。准确称取0.3850 g MnSO4·H2O样品置于锥形瓶中,加入H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用0.1000 mol·L-1硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗标准溶液20.00 mL。计算MnSO4·H2O样品的纯度_______ (请写出计算过程)。
(1)反应:将一定量MnO2粉和稀硫酸加入到如图所示实验装置的三颈烧瓶中,加热到90℃后开始加入MnS,并不断搅拌,充分反应。

①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为
②装置X中是NaOH溶液,作用是
(2)除杂。查阅资料可知:
Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11,Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 开始沉淀pH | 7.6 | 1.5 | 8.3 |
| 沉淀完全pH | 9.7 | 3.2 | 9.8 |

Mg2+去除率曲线为
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案:
(3)测定。准确称取0.3850 g MnSO4·H2O样品置于锥形瓶中,加入H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用0.1000 mol·L-1硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗标准溶液20.00 mL。计算MnSO4·H2O样品的纯度
MnO2是重要的化工原料,由软锰矿(主要成分为MnO2,主要杂质有Al2O3和SiO2)制备MnO2的一种工艺流程如下:
软锰矿
 Mn2+溶出液
Mn2+溶出液 Mn2+纯化液
Mn2+纯化液 MnO2
MnO2
已知:①金属离子沉淀的pH如下表。
②该工艺条件下,MnO2与H2SO4不反应,MnO2的氧化性随酸性的减弱逐渐减弱。
(1)溶出:溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示。 是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
②若Fe2+全部来自反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化:
①纯化时需要加入的试剂有MnO2和NH3·H2O,加入的顺序为___________ (填字母)。
A.先加入MnO2,后加入NH3·H2O B.先加入NH3·H2O,后加入MnO2
②加入氨水时,需要调节溶液pH的范围是___________ 。
(3)已知MnSO4可发生反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O。MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{ }与NaOH和MnSO4物质的量比值之间的关系如图所示。
}与NaOH和MnSO4物质的量比值之间的关系如图所示。___________ ,得到纯净的MnO2。(实验中可使用的试剂有1.0 mol·L-1 NaOH溶液、1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 BaCl2溶液)
软锰矿
已知:①金属离子沉淀的pH如下表。
| 金属离子 | Fe3+ | Al3+ | Mn2+ | Fe2+ |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出:溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示。
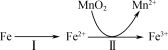
②若Fe2+全部来自反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化:
①纯化时需要加入的试剂有MnO2和NH3·H2O,加入的顺序为
A.先加入MnO2,后加入NH3·H2O B.先加入NH3·H2O,后加入MnO2
②加入氨水时,需要调节溶液pH的范围是
(3)已知MnSO4可发生反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O。MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网