解答题-原理综合题 适中0.65 引用4 组卷646
甲醇是重要的化工原料,也是重要的能源物质,可发展替代传统化石燃料。开发 加氢制甲醇技术既能解决温室效应等环境问题,又能有效提高资源的利用率。回答下列问题:
加氢制甲醇技术既能解决温室效应等环境问题,又能有效提高资源的利用率。回答下列问题:
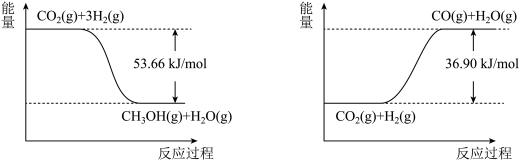
(1) 加氢分别生成甲醇和CO是最重要的两个基本反应,其反应如下:
加氢分别生成甲醇和CO是最重要的两个基本反应,其反应如下:

 ①
①

 ②
②

 ③
③
则反应③的
_______  。
。
(2) 加氢生成甲醇适宜在
加氢生成甲醇适宜在_______ (填“低温”“高温”“高压”“低压”,可多选)条件下进行,在实际生产过程中,通常会在原料气里掺一些CO,请从平衡移动角度分析原因:_______ 。
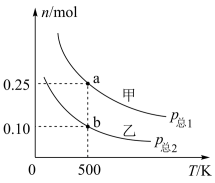
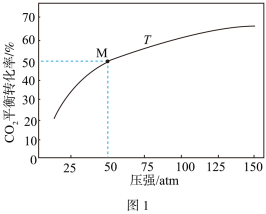
(3)在一恒温、容积可变的密闭容器中,充入1mol 与3mol
与3mol  发生反应:
发生反应:
 ,
, 在温度T下的平衡转化率与总压强的关系如图1所示,图中M点时
在温度T下的平衡转化率与总压强的关系如图1所示,图中M点时 的物质的量分数为
的物质的量分数为_______ ,该反应的压强平衡常数为
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4) 也可以通过电化学方法转化为
也可以通过电化学方法转化为 ,装置如图2所示。阴极的电极反应式为
,装置如图2所示。阴极的电极反应式为_______ ,若外接电源为铅蓄电池,铅蓄电池正极质量增加32g时,则标准状况下阳极生成_______ L  。
。

(1)
则反应③的
(2)
(3)在一恒温、容积可变的密闭容器中,充入1mol

(4)

2022·河北·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网