解答题-实验探究题 适中0.65 引用2 组卷111
已知硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,其摩尔质量为392g·mol-1]可用作净水剂、颜料、媒染剂、鞣革、防腐剂等,它在空气中不及硫酸亚铁容易被氧化,易溶于水,不溶于乙醇。回答下列问题:
I.制备过程
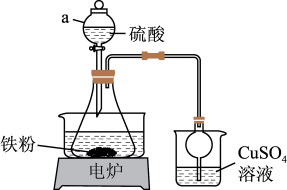
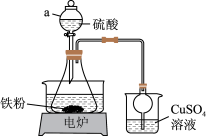
步骤1:制备硫酸亚铁溶液:将5.6g铁粉和 硫酸置于锥形瓶中,水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。
硫酸置于锥形瓶中,水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。
步骤2:获得硫酸亚铁铵晶体:向滤液中加入一定量的硫酸铵溶液,然后蒸发浓缩、冷却结晶、过滤、洗涤、晾干。
(1)步骤1中,加入过量铁粉的目的是___________ ;由于加入的铁粉不纯,反应过程中会产生少量H2S,可以用CuSO4溶液进行吸收处理,发生的反应化学方程式为:___________ 。
(2)步骤2中,所用到的硫酸铵溶液呈酸性,原因是___________ (用离子方程式表示),过滤后的硫酸亚铁铵晶体最好用___________ 洗涤;
II.定量分析——氧化还原滴定法
称取20.00g制得的硫酸亚铁铵晶体溶于稀硫酸,加水配制成100mL溶液,取25.00mL于锥形瓶中,然后用 的酸性高锰酸钾溶液进行滴定。
的酸性高锰酸钾溶液进行滴定。
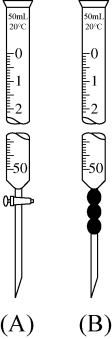
(3)滴定过程中高锰酸钾溶液应装在___________ 仪器中(填“A”或“B”);
(4)滴定终点的现象是___________ ;
(5)若进行平行滴定三次,消耗 溶液的体积如下表所示:
溶液的体积如下表所示:
则制得的硫酸亚铁铵晶体纯度(质量分数)为___________ (用百分数表示,保留小数点后两位);
(6)上表中第一次的数据明显大于后两次的数据,其原因可能是___________;
I.制备过程
步骤1:制备硫酸亚铁溶液:将5.6g铁粉和
步骤2:获得硫酸亚铁铵晶体:向滤液中加入一定量的硫酸铵溶液,然后蒸发浓缩、冷却结晶、过滤、洗涤、晾干。
(1)步骤1中,加入过量铁粉的目的是
(2)步骤2中,所用到的硫酸铵溶液呈酸性,原因是
II.定量分析——氧化还原滴定法
称取20.00g制得的硫酸亚铁铵晶体溶于稀硫酸,加水配制成100mL溶液,取25.00mL于锥形瓶中,然后用
(3)滴定过程中高锰酸钾溶液应装在

(4)滴定终点的现象是
(5)若进行平行滴定三次,消耗
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗 | 24.54 | 24.01 | 23.99 |
(6)上表中第一次的数据明显大于后两次的数据,其原因可能是___________;
| A.第一次滴定用的锥形瓶用待测液润洗过 |
| B.第一次滴定过程中高锰酸钾溶液滴出锥形瓶外 |
| C.第一次滴定前滴定管尖嘴无气泡,滴定后有气泡 |
| D.第一次滴定结束时,俯视读取酸性高锰酸钾溶液的体积 |
21-22高二上·重庆·期末
类题推荐
在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(1)为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是_________ .
A.用冷水洗
B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗
D.用90%的乙醇溶液洗
(2)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
滴定过程中发生反应的离子方程式为_________________________ 。
滴定终点的现象是____________________________ 。
通过实验数据计算的该产品纯度为______________ (用字母ac表)。上表中第一次实验中记录数据明显大于后两次,其原因可能是__________ (填符号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
(1)为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗
B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗
D.用90%的乙醇溶液洗
(2)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是
通过实验数据计算的该产品纯度为
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网