解答题-原理综合题 适中0.65 引用1 组卷57
以CO、CO2、CH4、CH3OH为原料的化学工艺,对控制环境污染有重要意义。
(1)治理汽车尾气的反应是2NO(g)+2CO(g) 2CO2(g)+N2(g),向体积为1L的密闭容器中充入2molNO和1molCO。
2CO2(g)+N2(g),向体积为1L的密闭容器中充入2molNO和1molCO。
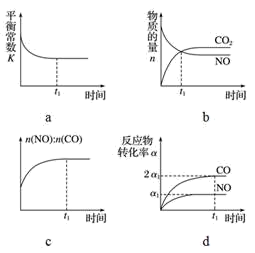
①图中正确且能说明反应在进行到t1时刻一定达到平衡状态的是____ (选填字母)。
a.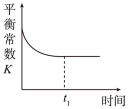 b.
b.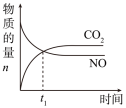 c.
c.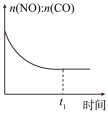 d.
d.
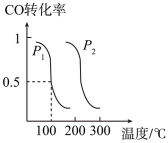
②平衡时,CO的转化率与温度、压强的关系如图所示。则p1___ p2(填“>”、“<”或“=”),100℃时,该反应的压强平衡常数Kp=___ (用含P1的计算式表示)。
(2)一定温度下,在三个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-bkJ/mol。相关数据如表:
CH3OH(g)+H2O(g) ΔH=-bkJ/mol。相关数据如表:
请回答:①2c1____ c3(填“>”、“<”或“=”);b=____ ,a=___ 。
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是____ mol/(L·s)。
(1)治理汽车尾气的反应是2NO(g)+2CO(g)
①图中正确且能说明反应在进行到t1时刻一定达到平衡状态的是
a.
 b.
b. c.
c. d.
d.
②平衡时,CO的转化率与温度、压强的关系如图所示。则p1

(2)一定温度下,在三个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) | 2molCO2(g)和6molH2(g) |
| 平衡时c(CH3OH) | c1 | c2 | c3 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
| H—H | C—H | C—O | C=O | O—H | |
| 键能kJ/mol | 436 | 415 | 326 | 803 | 464 |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是
21-22高二上·山西运城·期末
类题推荐
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
请回答:
①a=_______________ ;
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是___________ 。
(2)甲烷的一个重要用途是制取H2,其原理为CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1
2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____ (填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______ (填“大于”“小于”或“等于”)v(逆)。

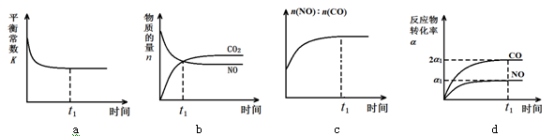
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是________ (填字母)。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和 3molH2(g) | 1mol CH3OH (g)和 1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
①a=
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是
(2)甲烷的一个重要用途是制取H2,其原理为CO2(g)+CH4(g)
 2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1
2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是
“C化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)⇌CH3OH g)+H2O(g)△H=﹣49.0kJ/mol.
相关数据如下:
请回答:
①c1__ c2(填“>”、“<”或“=”);c=__ kJ.
②同温同体积甲、乙达平衡时:a+b=_____ ,若甲、乙为体积相同的绝热容器,达平衡时a+b__________
(2)压强为p1时,向体积为1L的密闭容器中充入b mol CO 和2b mol H2,发生反应CO (g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示.请回答:该反应属于__ (填“吸热”或“放热”)反应;p1__ p2(填“>”、“<”或“=”)

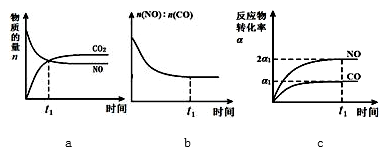
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)⇋2CO2(g)+N2(g)△H<0.在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是__ (选填字母).
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)⇌CH3OH g)+H2O(g)△H=﹣49.0kJ/mol.
相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时转化率 | a | b |
| 平衡时能量变化 | 放出29.4kJ | 吸收 c kJ |
请回答:
①c1
②同温同体积甲、乙达平衡时:a+b=
(2)压强为p1时,向体积为1L的密闭容器中充入b mol CO 和2b mol H2,发生反应CO (g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示.请回答:该反应属于

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)⇋2CO2(g)+N2(g)△H<0.在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是

“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、
HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H =﹣49.0 kJ/mol。相关数据如下:
CH3OH(g) + H2O(g) △H =﹣49.0 kJ/mol。相关数据如下:
请回答:①a = _________________________ 。
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是____________ 。
(2)甲烷的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1
2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1____ P2,(填“大于”或“小于”);压强为P2时,在y点:v(正)_____ v(逆)(填“大于”、“小于”或“等于”)。

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是
2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应。下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是_____ (选填字母)。
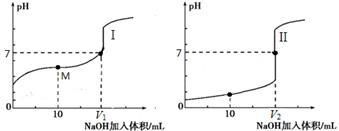
(4)甲酸(HCOOH)是一种弱酸,现用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和甲酸溶液,滴定曲线如下:滴定开始前,三种溶液中由水电离出的c(H+)最大的是____ ;V1和V2的关系V1___ V2(填 “>”、“=”或“<”);M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是______ 。
HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g) + 3H2(g)
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 1 mol CH3OH(g)和1 mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是
(2)甲烷的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)

(4)甲酸(HCOOH)是一种弱酸,现用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和甲酸溶液,滴定曲线如下:滴定开始前,三种溶液中由水电离出的c(H+)最大的是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


