解答题-结构与性质 适中0.65 引用1 组卷504
钛(Ti)被称为“未来金属”,其化合物广泛用于国防、电讯器材、医疗器械和化工设备等领域。回答下列问题:
(1)基态钛原子的价电子排布式为___________ ,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有___________ 种。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其它三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________ 。
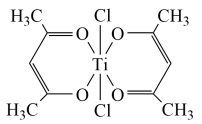
(3)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示:___________ 。
②请在图中标出配位键___________ (用“→”表示);
③配合物中非金属元素的含氧酸根的中心原子杂化轨道类型是sp2的是___________ 。
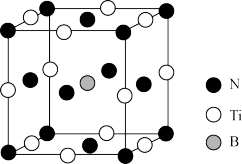
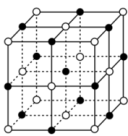
(4)用B掺杂TiN后(晶胞结构中只是B原子部分代替钛原子),其晶胞结构如图所示,距离Ti最近的B有___________ 个,Ti与B的最近距离为___________ nm;掺杂B后的晶体密度是TiN晶体的___________ 倍。(已知掺杂B后的晶体密度为ρg/cm3,阿伏加德罗常数的值为NA)
(1)基态钛原子的价电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其它三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示:

②请在图中标出配位键
③配合物中非金属元素的含氧酸根的中心原子杂化轨道类型是sp2的是
(4)用B掺杂TiN后(晶胞结构中只是B原子部分代替钛原子),其晶胞结构如图所示,距离Ti最近的B有
2022·贵州贵阳·一模
类题推荐
金属钛(Ti)及化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:
(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是___________ ,其电子占据最高能级的电子云轮廓图是___________
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是___________ ,它们的第二电离能(I2)分别为3051kJ/mol、1310kJ/mol,其原因是___________ 。
(3)钛与卤素形成的化合物TiX4熔点如下表
它们熔点差异的原因___________
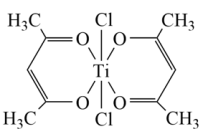
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为___________ ,与Ti形成配位键的元素是___________ ,碳碳键类型是___________ ;所含非金属元素的含氧酸根离子中心原子杂化轨道类型是sp2的是___________ 、立体构型是V形的是___________
(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=___________ g/cm3(阿伏加德罗常数值为NA,N、Ti的相对原子质量分别用Ar(N)和Ar(Ti)表示)

(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是
(3)钛与卤素形成的化合物TiX4熔点如下表
| TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点℃ | 377 | -24 | 38.3 | 153 |
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为

(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=

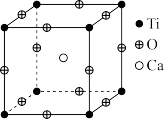
在高温超导领域,有一类化合物是钙钛矿型材料,此类化合物中最早被发现的是钛酸钙,其晶胞结构如图所示。试回答下列问题:
(1)基态Ti原子的核外电子排布式为____ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____ 。
(3)该钙钛矿的化学式为____ ,其组成元素的电负性由大到小的顺序是____ ;金属离子与氧离子间的作用力为____ ,该晶体中每个氧离子周围与它最近且距离相等的氧离子有____ 个。若晶胞参数为a pm,则晶体密度为____ g·cm-3(列出计算式,用NA表示阿伏加德罗常数的值)。

(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
金属钛(Ti)及化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:
(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是___________ (填元素符号),其电子占据最高能级的电子云轮廓图是___________
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是___________ ,它们的第二电离能(I2)分别为3051kJ/mol、1310kJ/mol,其原因是___________ 。
(3)钛与卤素形成的化合物TiX4熔点如下表
它们熔点差异的原因___________
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为___________ ,与Ti形成配位键的元素是___________ ,碳原子的杂化类型为___________ ;所含非金属元素的含氧酸根离子的立体构型是V形的是___________ (填离子符号)。
(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=___________ g/cm3(阿伏加德罗常数值为NA,用含NA的式子表示)
(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是
(3)钛与卤素形成的化合物TiX4熔点如下表
| TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点℃ | 377 | -24 | 38.3 | 153 |
它们熔点差异的原因
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为

(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


