解答题-原理综合题 适中0.65 引用2 组卷773
随着我国碳达峰、碳中和目标的确定,含碳化合物的综合利用备受关注。回答下列问题:
(1)已知某反应体系中主要涉及如下反应:
Ⅰ. ;
;
Ⅱ. 。
。
①反应Ⅰ和反应Ⅱ中,在热力学上趋势更大的是___________ (填“Ⅰ”或“Ⅱ”)。
②反应Ⅰ的一种溶剂化催化反应历程如图所示(其中TS表示过渡态)。
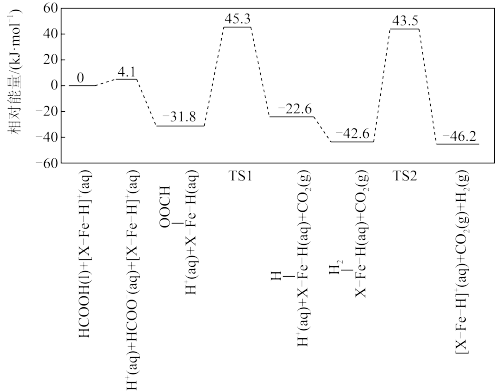
历程中生成___________ (填“TS1”或“TS2”)的反应步骤为总反应的决速步,反应过程的催化剂为___________ 。
③反应Ⅱ的催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应而降低积碳量,设计如下反应:
Ⅲ. ;
;
Ⅳ. 。
。
反应Ⅳ的 为
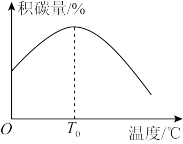
为___________ 。其他条件相同时,催化剂表面积碳量与温度的关系如图所示, 之后,温度升高积碳量减小的主要原因为
之后,温度升高积碳量减小的主要原因为___________ 。
(2)甲烷部分催化氧化剂制备乙炔是目前研究的热点之一、反应原理为:
 。
。
①该反应在___________ (填“较高”或“较低”)温度下能自发进行。
②一定温度下,将1 mol 充入10 L的固定容积容器中发生上述反应,实验测得反应前容器内压强为
充入10 L的固定容积容器中发生上述反应,实验测得反应前容器内压强为 ,容器内各气体分压与时间的关系如图所示。
,容器内各气体分压与时间的关系如图所示。
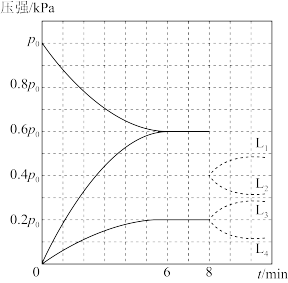
6~8 min时, 的浓度为
的浓度为___________  ,反应的平衡常数
,反应的平衡常数
___________ ;若8 min时改变的条件是缩小容器容积到5 L,其中 分压与时间关系可用图中曲线
分压与时间关系可用图中曲线___________ (填“ ”“
”“ ”“
”“ ”或“
”或“ ”)表示。
”)表示。
(1)已知某反应体系中主要涉及如下反应:
Ⅰ.
Ⅱ.
①反应Ⅰ和反应Ⅱ中,在热力学上趋势更大的是
②反应Ⅰ的一种溶剂化催化反应历程如图所示(其中TS表示过渡态)。

历程中生成
③反应Ⅱ的催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应而降低积碳量,设计如下反应:
Ⅲ.
Ⅳ.
反应Ⅳ的

(2)甲烷部分催化氧化剂制备乙炔是目前研究的热点之一、反应原理为:
①该反应在
②一定温度下,将1 mol

6~8 min时,
2022·广东湛江·一模
类题推荐
当前,我国公布了实现“碳达峰、碳中和”目标的具体时间。因此,含碳化合物的综合利用,有效缓解温室效应成为研究热点。回答下列问题:
(1)二氧化碳与氢气催化重整可制备甲醇,涉及反应:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+40.9 kJ·mol-1
CO(g)+H2O(g) ΔH2=+40.9 kJ·mol-1
①CH3OH(g)+2CO2(g) 3CO(g)+2H2O(g)的ΔH=
3CO(g)+2H2O(g)的ΔH=___________ 。
②相同温度下,向甲、乙两个恒容密闭容器中充入原料气,实验测得相关信息如下表所示。
容器甲中,0~5 min内的平均反应速率v(H2O)=___________ (用代数式表示);α1___________ α2(填“>”“<”或“=”,下同);ω1___________ ω2,判断该条件下甲、乙容器中CH3OH的平衡产率大小的理由为___________ 。
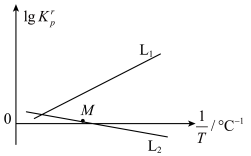
③已知: 表示相对压力平衡常数,其表达式是在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0(p0=100 kPa)。向恒容密闭容器中以物质的量之比为1∶3充入CO2和H2,测得反应前气体总压为400 kPa,反应Ⅰ、Ⅱ的相对压力平衡常数的对数与温度的倒数的关系如图所示。其中表示反应Ⅰ的相对压力平衡常数的对数与温度的倒数关系的曲线为
表示相对压力平衡常数,其表达式是在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0(p0=100 kPa)。向恒容密闭容器中以物质的量之比为1∶3充入CO2和H2,测得反应前气体总压为400 kPa,反应Ⅰ、Ⅱ的相对压力平衡常数的对数与温度的倒数的关系如图所示。其中表示反应Ⅰ的相对压力平衡常数的对数与温度的倒数关系的曲线为___________ (填“L1”或“L2”);若M点对应温度下,甲醇气的平衡分压为80 kPa,则H2的平衡转化率为___________ 。
(2)甲醇可催化解离为合成气:CH3OH(g) CO(g)+2H2(g) ΔH。科研人员结合实验和计算机模拟结果,研究了甲醇在钯(Pd)催化剂表面的解离反应,部分反应历程如图所示。其中吸附在催化剂表面的物种用“·”标注,TS表示过渡态。下列说法正确的是___________(填选项字母)。
CO(g)+2H2(g) ΔH。科研人员结合实验和计算机模拟结果,研究了甲醇在钯(Pd)催化剂表面的解离反应,部分反应历程如图所示。其中吸附在催化剂表面的物种用“·”标注,TS表示过渡态。下列说法正确的是___________(填选项字母)。
(1)二氧化碳与氢气催化重整可制备甲醇,涉及反应:
Ⅰ.CO2(g)+3H2(g)
Ⅱ.CO2(g)+H2(g)
①CH3OH(g)+2CO2(g)
②相同温度下,向甲、乙两个恒容密闭容器中充入原料气,实验测得相关信息如下表所示。
| 容器 | 容积/L | 起始加料/mol | 5 min末(未平衡)CO2转化率 | CH3OH的平衡产率 |
| 甲 | 10 | 1 mol CO2、3 mol H2 | α1 | ω1 |
| 乙 | 10 | 1 mol CO2、3 mol H2、0.2 mol CO | α2 | ω2 |
③已知:

(2)甲醇可催化解离为合成气:CH3OH(g)

| A.CH3OH· |
| B.上述历程中的最大能垒(活化能)E正=194 kJ·mol-1 |
| C.上述历程中碳原子价态未发生改变 |
| D.上述历程中的第一步反应适合在较高温度下进行 |
氯乙烯是制备塑料的重要中间体,可通过乙炔选择性催化加氢制备。已知:
Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.部分化学键的键能如表所示。
回答下列问题:
(1)表中x=______ 。
(2)较低温度下乙炔选择性催化加氢过程只发生反应Ⅰ和Ⅱ。一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为 充入
充入 和
和 ,发生反应Ⅰ和Ⅱ。实验测得反应前容器内压强为
,发生反应Ⅰ和Ⅱ。实验测得反应前容器内压强为 ,10min达到平衡时
,10min达到平衡时 、HCl(g)的分压分别为
、HCl(g)的分压分别为 、
、 。
。
① 内,反应的平均速率
内,反应的平均速率
______  (用分压表示,下同)。
(用分压表示,下同)。
② 的平衡转化率为
的平衡转化率为______ 。
③反应Ⅰ的平衡常数
______ 。
(3)高温度下,会发生反应Ⅲ而形成积碳,其可能导致的后果为______ (答出一点即可);不同压强下,向盛放催化剂的密闭容器中以物质的量之比为 充入
充入 和HCl(g)发生反应,实验测得乙炔的平衡转化率与温度的关系如图1所示。
和HCl(g)发生反应,实验测得乙炔的平衡转化率与温度的关系如图1所示。 、
、 、
、 由大到小的顺序为
由大到小的顺序为______ ;随温度升高,三条曲线逐渐趋于重合的原因为______ 。

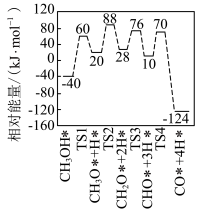
(4)结合试验和计算机模拟结果,有学者提出乙炔选择性催化加氢的反应历程,如图2所示,其中吸附在催化剂表面的物种用“*”标注,TS表示过渡态。下列说法正确的是______ (填选项字母)。
A.该历程中的最大能垒为
B.存在非极性键断裂和极性键形成
C.选择不同催化剂,最大能垒不发生变化
Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.部分化学键的键能如表所示。
| 化学键 | |||||
| 键能 | 347.7 | x | 413.4 | 340.2 | 431.8 |
(1)表中x=
(2)较低温度下乙炔选择性催化加氢过程只发生反应Ⅰ和Ⅱ。一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为
①
②
③反应Ⅰ的平衡常数
(3)高温度下,会发生反应Ⅲ而形成积碳,其可能导致的后果为

(4)结合试验和计算机模拟结果,有学者提出乙炔选择性催化加氢的反应历程,如图2所示,其中吸附在催化剂表面的物种用“*”标注,TS表示过渡态。下列说法正确的是
A.该历程中的最大能垒为
B.存在非极性键断裂和极性键形成
C.选择不同催化剂,最大能垒不发生变化
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




