解答题-工业流程题 较难0.4 引用1 组卷245
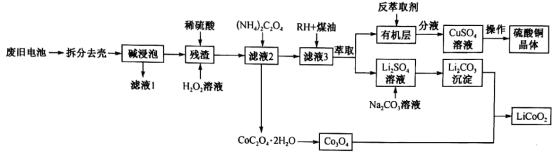
锂离子电池的广泛应用要求处理电池废料以节约资源、保护环境。钴酸锂电池的正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及镀镍金属钢壳,处理该废旧电池的一种工艺如图所示。
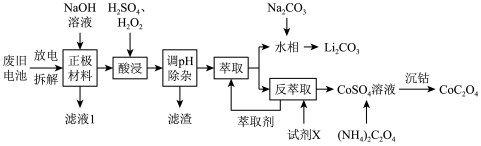
回答下列问题:
(1)用NaOH 溶液处理正极材料是为了除去废旧电池中的___________ ,为提高该物质的去除率可采取的措施有___________ (任写两条)。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为___________ 。在“酸浸”过程中所用H2O2远高于理论用量,造成这一结果的原因为___________ 。
(3)“萃取”和“反萃取”可简单表示为 ,则反萃取过程中加入的试剂X是
,则反萃取过程中加入的试剂X是___________ (填化学式)。
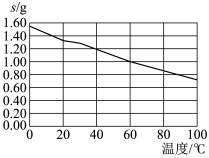
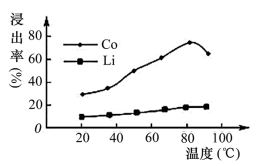
(4)已知Li2CO3溶解度随温度变化曲线如下图所示。加入 Na2CO3溶液后应进行的操作是___________ 。
(5)设溶液中c(Co2+)=0.1mol•L-1,为沉淀Co2+,向CoSO4溶液中加入(NH4)2C2O4而不是Na2C2O4。利用如下数据通过列式计算说明原因:___________ 。已知:25℃时0.1mol•L-1(NH4)2C2O4溶液的pH约为6.4;0.1mol•L-1Na2C2O4溶液的pH约为8.35; Ksp[Co(OH)2]=6.0×10-15。

回答下列问题:
(1)用NaOH 溶液处理正极材料是为了除去废旧电池中的
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为
(3)“萃取”和“反萃取”可简单表示为
(4)已知Li2CO3溶解度随温度变化曲线如下图所示。加入 Na2CO3溶液后应进行的操作是

(5)设溶液中c(Co2+)=0.1mol•L-1,为沉淀Co2+,向CoSO4溶液中加入(NH4)2C2O4而不是Na2C2O4。利用如下数据通过列式计算说明原因:
21-22高三上·四川成都·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
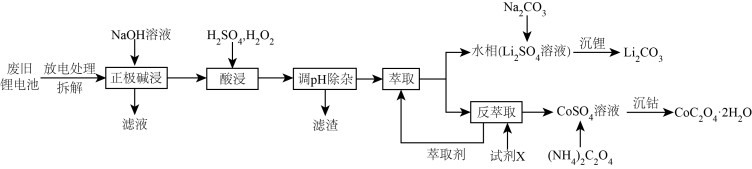



 Co(HA2)2+2H+,则反萃取过程加入的试剂X是
Co(HA2)2+2H+,则反萃取过程加入的试剂X是

