解答题-原理综合题 适中0.65 引用1 组卷120
氨是最重要的氮肥,也是产量最大的化工产品之一。合成氨工艺是人工固氮的重要途径。
(1)已知:气态分子中l mol化学键解离成气态原子所吸收的能量,叫做该化学键的键能(kJ· mol-1)。一些键能数据如下表:
反应N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=________ kJ·mol-1
(2)化学家格哈德·埃特尔在哈伯研究所证实了部分参加反应的分子在固体催化剂表面合成氨的反应过程,模拟示意图如下:
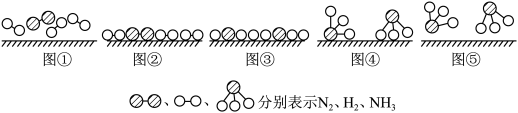
i.图②表示N2、H2被吸附在催化剂表面,图⑤表示生成的NH3离开催化剂表面,图②到图③的过程___________ 能量(填“吸收”或“放出”)。
ii.N2的吸附分解反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料N2和H2物质的量之比为1∶2.8,分析说明N2过量的理由是:原料气中N2相对易得、___________ 和___________ 。
iii.关于合成氨工艺,下列说法正确的是___________ 。
A.控制温度(773K)远高于室温,是为了提高平衡转化率和加快化学反应速率
B.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,利于化学平衡向正反应方向移动
C.当温度、体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率
D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(3)在恒容密闭容器中按物质的量比1:3投入氮气和氢气,发生反应:N2(g)+ 3H2(g) 2NH3(g),分别在200℃、400℃、 600℃条件下进行反应,平衡时,NH3的物质的量分数与总压强的关系如图所示:
2NH3(g),分别在200℃、400℃、 600℃条件下进行反应,平衡时,NH3的物质的量分数与总压强的关系如图所示:
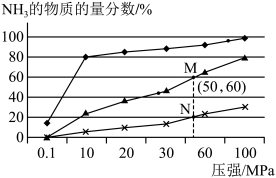
i.M点和N点的平衡常数大小关系是KN___________ KM (填">”、“<”或者“=”)。
ii.M点的平衡常数为Kp=___________ MPa-2 (计算结果保留到小数点后两位。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。)
(4)已知液氨中存在:2NH3(l)
 +
+ 。用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是
。用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___________ 。
(1)已知:气态分子中l mol化学键解离成气态原子所吸收的能量,叫做该化学键的键能(kJ· mol-1)。一些键能数据如下表:
| 化学键 | N≡N | H-H | N-H |
| 键能E(kJ·mol-1) | 946.0 | 436.0 | 390.8 |
反应N2(g)+3H2(g)
(2)化学家格哈德·埃特尔在哈伯研究所证实了部分参加反应的分子在固体催化剂表面合成氨的反应过程,模拟示意图如下:

i.图②表示N2、H2被吸附在催化剂表面,图⑤表示生成的NH3离开催化剂表面,图②到图③的过程
ii.N2的吸附分解反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料N2和H2物质的量之比为1∶2.8,分析说明N2过量的理由是:原料气中N2相对易得、
iii.关于合成氨工艺,下列说法正确的是
A.控制温度(773K)远高于室温,是为了提高平衡转化率和加快化学反应速率
B.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,利于化学平衡向正反应方向移动
C.当温度、体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率
D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(3)在恒容密闭容器中按物质的量比1:3投入氮气和氢气,发生反应:N2(g)+ 3H2(g)

i.M点和N点的平衡常数大小关系是KN
ii.M点的平衡常数为Kp=
(4)已知液氨中存在:2NH3(l)
21-22高三上·河北邯郸·阶段练习
知识点:根据△H=反应物的键能之和-生成物的键能之和进行计算勒夏特列原理的应用化学平衡常数的有关计算电解池电极反应式及化学方程式的书写与判断 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
合成氨是人类科学技术发展史上的一项重大突破,诺贝尔化学奖曾三次授予与合成氨有关的研究。以下是关于合成氨的有关问题,请回答:
 N2(g)+
N2(g)+  H2(g)
H2(g)  NH3(g) ΔH(298K)= -46.2kJ· mol-l
NH3(g) ΔH(298K)= -46.2kJ· mol-l
在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附: N2(g) →2N*; H2(g)→2H*;
表面反应: N*+ H* NH*; NH*+ H*
NH*; NH*+ H* NH2*; NH2* + H*
NH2*; NH2* + H* NH3*
NH3*
脱附: NH3* NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率小,决定了合成氨的整体反应速率。
(1)平衡后,若想提高H2的转化率,可以采取的措施有 _______。
(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应: N2(g) + 3H2(g)  2NH3(g) ΔH = - 92.4kJ·mol-1, 请完成下列问题:
2NH3(g) ΔH = - 92.4kJ·mol-1, 请完成下列问题:
①试比较K1、K2的大小,K1_______ K2 (填“>”、“<”或“=”)
②400℃时,反应2NH3(g) N2(g) + 3H2(g)的化学平衡常数为
N2(g) + 3H2(g)的化学平衡常数为_______ 。当NH3、N2和H2的物质的量分别为2mol、a mol和1mol时,v(N2)正=v(N2)逆。a=_______ 。
(3)关于合成氨工艺的理解,正确的是_______
(4)实际生产中,常用工艺条件: Fe 作催化剂,控制温度500℃,压强3.0×105Pa,原料中N2和H2物质的量之比为1:2.8。分析说明原料气中N2过量的理由有哪些? _______
在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附: N2(g) →2N*; H2(g)→2H*;
表面反应: N*+ H*
脱附: NH3*
其中,N2的吸附分解反应活化能高、速率小,决定了合成氨的整体反应速率。
(1)平衡后,若想提高H2的转化率,可以采取的措施有 _______。
| A.加入催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,反应2NH3(g)
(3)关于合成氨工艺的理解,正确的是_______
| A.控制温度(500℃) 远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率 |
| B.当温度压强一定时,在原料气(N2 和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率 |
| C.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,利于反应正向进行 |
| D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气需经过净化处理,以防止催化剂中毒和安全事故发生 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



