解答题-实验探究题 较难0.4 引用2 组卷1028
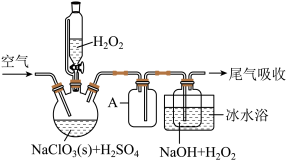
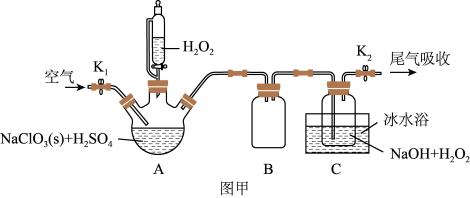
ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2或NaClO2·3H2O固体以便运输和贮存。过氧化氢法制备NaClO2的实验装置如图甲所示。
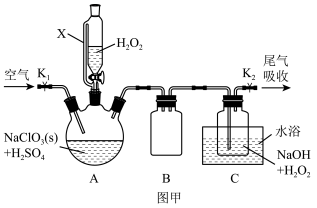
已知:①2NaClO3+H2O2+H2SO4 = 2ClO2↑+O2↑+Na2SO4+2H2O;
②ClO2的熔点为—59°C,沸点为11°C,H2O2 的沸点为150°C;
③当温度低于38°C时,NaClO2 饱和溶液中析出的晶体是NaClO2·3H2O。当温度在38-60°C时,析出NaClO2;温度高于60°C时,NaClO2分解。
(1)图甲所示装置组装完毕后,首先进行的操作是_______ 。
(2)Cl—对ClO2的生成有一定催化作用。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率会大大提高。该过程经两步反应完成,将其补充完整。
①2ClO +2Cl—+4H+=Cl2↑+2ClO2↑+2H2O;
+2Cl—+4H+=Cl2↑+2ClO2↑+2H2O;
②_______ (用离子方程式表示)。
(3)C装置中应使用_______ (填 “冰”或“热”)水浴;空气流速过快或过慢,均会降低NaClO2产率,其原因可能是_______ 。
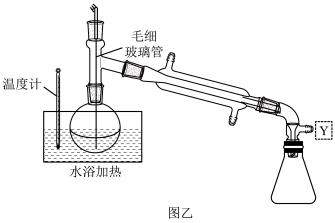
(4)实验室利用装置乙分离C装置中的NaClO2,Y处应连接一个装置,目的是_______ 。水浴加热的温度最好控制在_______ °C左 右(填字母)。大量晶体析出后,过滤,洗涤,干燥。
a.35 b.55 c. 70 d. 100
(5)图乙中起冷却作用的仪器名称是_______ 。
(6)产品纯度的测定:称取mg产品配成100 mL溶液,取25.00mL溶液,加入足量的KI和稀H2SO4充分反应后加入指示剂,用c mol·L-1 Na2S2O3标准溶液滴定至终点(I2+2S2O =2I-+S4O
=2I-+S4O ),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是
),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是_______ 。(用含m、c、V的式子表示)

已知:①2NaClO3+H2O2+H2SO4 = 2ClO2↑+O2↑+Na2SO4+2H2O;
②ClO2的熔点为—59°C,沸点为11°C,H2O2 的沸点为150°C;
③当温度低于38°C时,NaClO2 饱和溶液中析出的晶体是NaClO2·3H2O。当温度在38-60°C时,析出NaClO2;温度高于60°C时,NaClO2分解。
(1)图甲所示装置组装完毕后,首先进行的操作是
(2)Cl—对ClO2的生成有一定催化作用。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率会大大提高。该过程经两步反应完成,将其补充完整。
①2ClO
②
(3)C装置中应使用
(4)实验室利用装置乙分离C装置中的NaClO2,Y处应连接一个装置,目的是

a.35 b.55 c. 70 d. 100
(5)图乙中起冷却作用的仪器名称是
(6)产品纯度的测定:称取mg产品配成100 mL溶液,取25.00mL溶液,加入足量的KI和稀H2SO4充分反应后加入指示剂,用c mol·L-1 Na2S2O3标准溶液滴定至终点(I2+2S2O
2022·吉林长春·二模
类题推荐  是一种优良的消毒剂,浓度过高时易发生爆炸,常将其制备成
是一种优良的消毒剂,浓度过高时易发生爆炸,常将其制备成 或
或 固体以便运输和贮存.过氧化氢法制备NaClO2的实验装置如图甲所示.
固体以便运输和贮存.过氧化氢法制备NaClO2的实验装置如图甲所示.
已知:①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;
②当温度低于38℃时, 饱和溶液中析出的晶体是
饱和溶液中析出的晶体是 .当温度在
.当温度在 时,析出
时,析出 ;温度高于
;温度高于 时,
时, 分解
分解
(1)图甲中装置组装完毕后,首先进行的操作是_______
(2) 对
对 的生成有一定催化作用.反应开始时在三颈烧瓶中加入少量盐酸,
的生成有一定催化作用.反应开始时在三颈烧瓶中加入少量盐酸, 的生成速率会大大提高。该过程分两步完成,将其补充完整:
的生成速率会大大提高。该过程分两步完成,将其补充完整:
① ;
;
②_______ (写离子方程式)
(3)实验中通空气的作用除了将 气体排入装置C中与混合溶液充分反应生成
气体排入装置C中与混合溶液充分反应生成 之外,还有
之外,还有_______
(4)实验室利用图乙减压蒸馏装置分离C装置中的 ,水浴加热的温度最好控制在_______
,水浴加热的温度最好控制在_______ 左右(填字母):
左右(填字母):
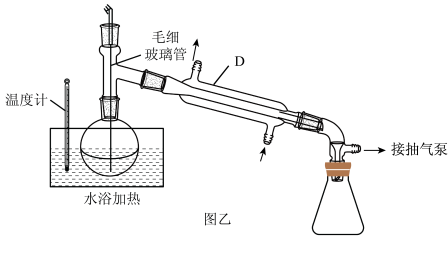
(5)图乙中仪器D的名称是_______ .
(6)用ClO2处理过的饮用水常含有一定量的 ,饮用水中
,饮用水中 和
和 的含量可用连续碘量法进行测定。已知
的含量可用连续碘量法进行测定。已知 被
被 还原为
还原为 或
或 的转化率与溶液的
的转化率与溶液的 关系如图所示。反应生成的
关系如图所示。反应生成的 用标准
用标准 溶液滴定,原理为:
溶液滴定,原理为: 。
。

滴定过程为:
准确量取 水样加入到碘量瓶中,调节水样的
水样加入到碘量瓶中,调节水样的 为7~8,加入足量的KI晶体,充分反应后,用
为7~8,加入足量的KI晶体,充分反应后,用 溶液滴定至淡黄色,加入淀粉溶液,滴定至第一次终点,消耗
溶液滴定至淡黄色,加入淀粉溶液,滴定至第一次终点,消耗 溶液
溶液 ;调节溶液的
;调节溶液的 ,继续用
,继续用 溶液滴定至第二次终点,消耗
溶液滴定至第二次终点,消耗 溶液
溶液 。
。
①当pH≤2.0时, 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
②两次滴定终点的现象_______ (填“相同”或“不相同”)。根据上述数据,该水样中的 浓度为
浓度为_______  (用含字母的代数式表示)。
(用含字母的代数式表示)。

已知:①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;
②当温度低于38℃时,
(1)图甲中装置组装完毕后,首先进行的操作是
(2)
①
②
(3)实验中通空气的作用除了将
(4)实验室利用图乙减压蒸馏装置分离C装置中的

| A.35 | B.55 | C.70 | D.100 |
(6)用ClO2处理过的饮用水常含有一定量的

滴定过程为:
准确量取
①当pH≤2.0时,
②两次滴定终点的现象
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网