解答题-实验探究题 适中0.65 引用1 组卷59
甲酸铜[(HCOO)2Cu]在工业生产中有广泛的用途,某工业甲酸铜纯度测定如下:
Ⅰ.准确称取0.1540g样品于锥形瓶中,加入10mL蒸馏水溶解,滴加1mol·L-1H2SO4,配制成pH≤3的溶液;
Ⅱ.加5mL20%碘化钾溶液(过量),用浓度为0.1932mol·L-1的Na2S2O3标准溶液滴定至溶液呈浅黄色,再加入2mL0.5%淀粉溶液;
Ⅲ.继续滴定到溶液变成浅蓝色,加入5mL10%KSCN溶液,振荡,溶液蓝色加深;
Ⅳ.继续滴定至终点,共消耗5.00mL标准溶液。
已知:①Cu2++I-→CuI↓+I2;I2+S2O →I-+S4O
→I-+S4O ,I2+I-
,I2+I- I
I (方程式未配平);
(方程式未配平);
②CuI可吸附I ,[Ksp(CuI)=1.1×10-10,Ksp(CuSCN)=1.1×10-14];
,[Ksp(CuI)=1.1×10-10,Ksp(CuSCN)=1.1×10-14];
③样品中的杂质不参与任何反应。
回答下列问题:
(1)准确称取0.1540g样品应选用____ (填序号)。
A.托盘天平 B.分析天平(精确度:0.01g) C.分析天平(精确度:0.0001g)
(2)滴定时用____ (填“酸式”或“碱式”)滴定管装标准溶液。
(3)步骤Ⅰ加硫酸调节溶液pH≤3的目的是____ 。
(4)滴定终点的实验现象是____ 。
(5)步骤Ⅲ中加入5mL10%KSCN溶液的目的是____ 。
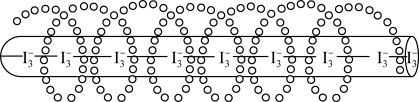
(6)淀粉溶液和碘单质显色原理:I 钻入淀粉螺旋隧道中(如图)。若实验一开始就加入淀粉溶液会使滴定终点滞后,导致实验结果
钻入淀粉螺旋隧道中(如图)。若实验一开始就加入淀粉溶液会使滴定终点滞后,导致实验结果____ (填“偏大”“偏小”或“无影响”)。
(7)样品的纯度为____ %。
(8)在上述方案基础上,下列措施能进一步提高准确度的有____ (填序号)。
Ⅰ.准确称取0.1540g样品于锥形瓶中,加入10mL蒸馏水溶解,滴加1mol·L-1H2SO4,配制成pH≤3的溶液;
Ⅱ.加5mL20%碘化钾溶液(过量),用浓度为0.1932mol·L-1的Na2S2O3标准溶液滴定至溶液呈浅黄色,再加入2mL0.5%淀粉溶液;
Ⅲ.继续滴定到溶液变成浅蓝色,加入5mL10%KSCN溶液,振荡,溶液蓝色加深;
Ⅳ.继续滴定至终点,共消耗5.00mL标准溶液。
已知:①Cu2++I-→CuI↓+I2;I2+S2O
②CuI可吸附I
③样品中的杂质不参与任何反应。
回答下列问题:
(1)准确称取0.1540g样品应选用
A.托盘天平 B.分析天平(精确度:0.01g) C.分析天平(精确度:0.0001g)
(2)滴定时用
(3)步骤Ⅰ加硫酸调节溶液pH≤3的目的是
(4)滴定终点的实验现象是
(5)步骤Ⅲ中加入5mL10%KSCN溶液的目的是
(6)淀粉溶液和碘单质显色原理:I

(7)样品的纯度为
(8)在上述方案基础上,下列措施能进一步提高准确度的有
| A.适当提高称量样品的质量 |
| B.用硝酸代替硫酸 |
| C.进行平行实验 |
| D.将标准溶液稀释至更低的浓度 |
21-22高三·云南昆明·阶段练习
类题推荐
硫酸铜晶体在工农业生产中具有重要作用。某学习小组对硫酸铜晶体的制备和纯度的测定进行如下探究。
(1)粗硫酸铜晶体的制备
在盛有铜屑的蒸发皿中加入20mL3 mol·L-1的硫酸,水浴加热,分多次缓慢加入浓硝酸,待反应缓和后,盖上表面皿。将所得溶液加热浓缩、趁热过滤,冷却,得到粗硫酸铜晶体。反应原理为浓硝酸将铜氧化成Cu2+,Cu2+与 结合得到硫酸铜,该反应的化学方程式为
结合得到硫酸铜,该反应的化学方程式为__ 。
(2)硫酸铜晶体的提纯
实验室提纯硫酸铜晶体的一种方法如下:

①提纯过程中需要加入氧化剂,检验其氧化完全的方法是___ 。
②溶液中金属离子开始沉淀和沉淀完全的pH如下表所示。提纯过程中需要调节pH=4.0,其原因是_____ 。
③操作I、I、III都要用到的玻璃仪器有___ 。
(3)硫酸铜晶体纯度的测定
称取样品0.3125g于250mL锥形瓶中,加入适量稀硫酸和水使之完全溶解。加入过量的KI溶液(杂质不参与反应),用0.1000 mol·L-1Na2S2O3溶液滴定至呈淡黄色。然后加入几滴淀粉溶液,继续滴定至呈浅蓝色。再加入适量的KSCN溶液,摇匀后溶液蓝色转深,再继续滴定,达到滴定终点时消耗Na2S2O3溶液10.00mL。(已知:2Cu2++4I-=2CuI↓+I2,I2+2 =
= +2I-)
+2I-)
①本实验中加入适量的KSCN溶液的作用是____ 。[已知Ksp(CuI)=1.1×10-12,Ksp(CuSCN)]=4.8×10-15,CuI沉淀表面易吸附I2,CuSCN沉淀不吸附I2]
②达到滴定终点时的现象是___ 。
③所测试样中硫酸铜晶体的纯度为__ 。
(1)粗硫酸铜晶体的制备
在盛有铜屑的蒸发皿中加入20mL3 mol·L-1的硫酸,水浴加热,分多次缓慢加入浓硝酸,待反应缓和后,盖上表面皿。将所得溶液加热浓缩、趁热过滤,冷却,得到粗硫酸铜晶体。反应原理为浓硝酸将铜氧化成Cu2+,Cu2+与
(2)硫酸铜晶体的提纯
实验室提纯硫酸铜晶体的一种方法如下:

①提纯过程中需要加入氧化剂,检验其氧化完全的方法是
②溶液中金属离子开始沉淀和沉淀完全的pH如下表所示。提纯过程中需要调节pH=4.0,其原因是
| 金属离子 | Fe3+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 4.7 |
| 沉淀完全时的pH | 3.2 | 6.7 |
(3)硫酸铜晶体纯度的测定
称取样品0.3125g于250mL锥形瓶中,加入适量稀硫酸和水使之完全溶解。加入过量的KI溶液(杂质不参与反应),用0.1000 mol·L-1Na2S2O3溶液滴定至呈淡黄色。然后加入几滴淀粉溶液,继续滴定至呈浅蓝色。再加入适量的KSCN溶液,摇匀后溶液蓝色转深,再继续滴定,达到滴定终点时消耗Na2S2O3溶液10.00mL。(已知:2Cu2++4I-=2CuI↓+I2,I2+2
①本实验中加入适量的KSCN溶液的作用是
②达到滴定终点时的现象是
③所测试样中硫酸铜晶体的纯度为
某铜合金中Cu的质量分数为80%~90%,还含有Fe等。通常用间接碘量法测定其中Cu的含量,步骤如下:
I.称取0.6350g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2,冷却后过滤,将滤液配制成250mL溶液;
II.取50.00mL滤液于锥形瓶中,加入NH4F溶液,将溶液中的Fe3+化为无色稳定的 ,防止其氧化I-,充分反应后,加入
,防止其氧化I-,充分反应后,加入过量 KI溶液,生成白色沉淀,溶液呈棕黄色;
III.向II的锥形瓶中加入0.1000mol·L-1Na2S2O3溶液滴定,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6(无色)。至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点;
IV.平行测定三次,三次消耗Na2S2O3溶液的体积如下表所示:
V.计算铜的质量分数。
已知:i.I2在水中溶解度小,易挥发。
ii.I2+I-⇌ (棕黄色)。
(棕黄色)。
(1)I中Cu溶解的离子方程式是___ 。
(2)将滤液配制成250mL溶液,所用的仪器除玻璃棒和烧杯外,还有___ 。
(3)II中Cu2+和I-反应生成CuI白色沉淀和I2。
①Cu2+和I-反应的离子方程式是____ 。
②加入过量KI溶液的作用是______ 。
(4)在滴定管中装入Na2S2O3标准溶液的前一步,应进行的操作为:____ 。
(5)室温时,CuSCN的溶度积比CuI小。CuI沉淀表面易吸附I2和 ,III中,在滴定至终点前若不加KSCN溶液,则使测定结果
,III中,在滴定至终点前若不加KSCN溶液,则使测定结果___ 。(填“偏高”、“偏低”或“无影响”)
(6)IV所消耗的Na2S2O3标准溶液平均体积为___ mL,V计算得到样品中Cu的质量分数为_ 。
I.称取0.6350g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2,冷却后过滤,将滤液配制成250mL溶液;
II.取50.00mL滤液于锥形瓶中,加入NH4F溶液,将溶液中的Fe3+化为无色稳定的
III.向II的锥形瓶中加入0.1000mol·L-1Na2S2O3溶液滴定,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6(无色)。至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点;
IV.平行测定三次,三次消耗Na2S2O3溶液的体积如下表所示:
实验序号 | 1 | 2 | 3 |
| 消耗Na2S2O3标准溶液体积/mL | 17.02 | 16.98 | 17.24 |
已知:i.I2在水中溶解度小,易挥发。
ii.I2+I-⇌
(1)I中Cu溶解的离子方程式是
(2)将滤液配制成250mL溶液,所用的仪器除玻璃棒和烧杯外,还有
(3)II中Cu2+和I-反应生成CuI白色沉淀和I2。
①Cu2+和I-反应的离子方程式是
②加入过量KI溶液的作用是
(4)在滴定管中装入Na2S2O3标准溶液的前一步,应进行的操作为:
(5)室温时,CuSCN的溶度积比CuI小。CuI沉淀表面易吸附I2和
(6)IV所消耗的Na2S2O3标准溶液平均体积为
Ⅰ.工业废水中常含有一定量氧化性较强的 ,利用滴定原理测定
,利用滴定原理测定 含量的方法如下:
含量的方法如下:
步骤一:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤二:加入过量的碘化钾溶液充分反应: 。
。
步骤三:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol/L 溶液进行滴定,数据记录如表:(
溶液进行滴定,数据记录如表:( )
)
(1)步骤Ⅰ量取30.00mL废水选择的仪器是___________ 。
(2)步骤Ⅲ中滴定达到终点时的实验现象是___________ 。
(3)步骤Ⅲ中a的读数如图所示,则:___________ mL。
②计算废水中 含量为
含量为___________ mol/L。
(4)以下操作会造成废水中 含量测定值偏高的是___________(填字母)。
含量测定值偏高的是___________(填字母)。
Ⅱ.佛尔哈德法可测定经过提纯后的产品中 的含量:准确称取1.705g样品在水解瓶中摇动至完全水解,将水解液配成100mL,取10.00mL于锥形瓶中,加
的含量:准确称取1.705g样品在水解瓶中摇动至完全水解,将水解液配成100mL,取10.00mL于锥形瓶中,加 的
的 溶液20.00mL(
溶液20.00mL(
 ),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖,加入指示剂,用
),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖,加入指示剂,用 KSCN标准溶液滴定过量的
KSCN标准溶液滴定过量的 至终点(
至终点( )。
)。
已知: ,
,
(5) 水解方程式为
水解方程式为___________ 。
(6)实验中,若不加硝基苯,测定 的纯度将
的纯度将___________ (填“偏大”“偏小”或“无影响”)。
步骤一:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤二:加入过量的碘化钾溶液充分反应:
步骤三:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol/L
| 滴定次数 | ||
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
(1)步骤Ⅰ量取30.00mL废水选择的仪器是
(2)步骤Ⅲ中滴定达到终点时的实验现象是
(3)步骤Ⅲ中a的读数如图所示,则:

②计算废水中
(4)以下操作会造成废水中
| A.滴定开始时滴定管尖嘴处有气泡,滴定后气泡消失 |
| B.量取 |
| C.滴定终点读数时,俯视滴定管的刻度 |
| D.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
Ⅱ.佛尔哈德法可测定经过提纯后的产品中
已知:
(5)
(6)实验中,若不加硝基苯,测定
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


