解答题-原理综合题 适中0.65 引用1 组卷196
以氢气、一氧化碳为主要组分的合成气是一种重要的化工原料,可以合成二甲醚、甲醇等许多重要的化工产品。回答下列问题:
(1)已知反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(l) △H1=-2.8kJ·mol-1
CO(g)+H2O(l) △H1=-2.8kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H2=-122.5kJ·mol-1
CH3OCH3(g)+3H2O(g) △H2=-122.5kJ·mol-1
1mol液态水全部蒸发为气态水吸收44.0kJ的能量,则以气态CO和气态H2为原料制备气态CH3OCH3和水蒸气的热化学方程式是___ 。
(2)在一温度恒定的密闭容器中通入一定量的CO和H2,在催化剂作用下转化为CH3OCH3(g),当CO与H2的投料比为____ 时,混合气体CH3OCH3的体积分数最大;为了提高CH3OCH3的平衡产率,不改变温度,可以采取的措施有____ (答出一条即可)。
(3)改用不同的催化剂可以利用合成气制备甲醇,反应方程式为CO(g)+2H2(g) CH3OCH3(g) △H<0,v正=k正x(CO)·x2(H2),v逆=k逆x(CH3OCH3),k正、k逆分别为正逆反应速率常数,x为物质的量分数。
CH3OCH3(g) △H<0,v正=k正x(CO)·x2(H2),v逆=k逆x(CH3OCH3),k正、k逆分别为正逆反应速率常数,x为物质的量分数。
①该反应在某条件下达到平衡后,降低温度,k正___ (填“增大”或“减小,下同),k逆___ ,且k正的变化程度___ (填“大于”“小于”“等于”)k逆变化的程度。
②在实验室模拟工业合成甲醇的反应,在一恒压密闭容器内充入1mol CO、2mol H2和1mol He(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如表:
则氢气的平衡转化率为___ ,该温度下的平衡常数Kp为____ (MPa)-2(Kp为以分压表示的平衡常数,请用含p的式子表示)。
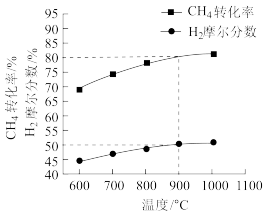
(4)利用二氧化碳和甲烷经催化重整,可以制得合成气:CO2(g)+CH4(g) 2CO(g)+2H2(g),按一定体积比加入甲烷和二氧化碳,在恒容条件下发生反应,温度对CO和H2产率的影响如图所示。则下列叙述正确的是
2CO(g)+2H2(g),按一定体积比加入甲烷和二氧化碳,在恒容条件下发生反应,温度对CO和H2产率的影响如图所示。则下列叙述正确的是___ 。

(1)已知反应Ⅰ:CO2(g)+H2(g)
反应Ⅱ:2CO2(g)+6H2(g)
1mol液态水全部蒸发为气态水吸收44.0kJ的能量,则以气态CO和气态H2为原料制备气态CH3OCH3和水蒸气的热化学方程式是
(2)在一温度恒定的密闭容器中通入一定量的CO和H2,在催化剂作用下转化为CH3OCH3(g),当CO与H2的投料比为
(3)改用不同的催化剂可以利用合成气制备甲醇,反应方程式为CO(g)+2H2(g)
①该反应在某条件下达到平衡后,降低温度,k正
②在实验室模拟工业合成甲醇的反应,在一恒压密闭容器内充入1mol CO、2mol H2和1mol He(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如表:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 容器体积/L | 4 | 3.5 | 3.2 | 3.0 | 2.9 | 2.8 | 2.8 |
(4)利用二氧化碳和甲烷经催化重整,可以制得合成气:CO2(g)+CH4(g)

| A.该反应△H>0 |
| B.此反应的优选温度为1000℃ |
| C.在恒压条件下进行该反应,产率将更高 |
| D.催化剂的使用可以降低反应的活化能,从而使平衡产率提高 |
21-22高三下·山东聊城·开学考试
类题推荐
用CO2、CO和H2在催化剂作用下制取甲烷、甲醇、乙烯等有重要的意义。
(1)已知

①已知:H2的标准燃烧热为286kJ·mol-1,H2O(g)=H2O(1) △H3=-44kJ·mol-1,计算△H1=_____ kJ·mol-1。
②已知在一定温度下的发生反应: ,
, ,(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=
,(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=_____ k逆。升高温度,k正增大的倍数_____ (填“大于”“小于”或等于”)k逆增大的倍数。
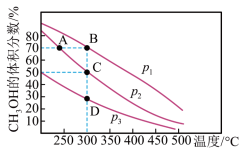
(2)利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下: 。向恒容为2L的密闭反应器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的_____。
。向恒容为2L的密闭反应器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的_____。
(3)以CO2为原料催化加氢合成C2H4的反应方程式: 。常压下,FeCoMnK/BeO作催化剂,按n(CO2):n(H2)=l:3(总物质的量为4amol)的投料比充入密闭容器中发生反应,测得温度对CO2的平衡转化率和催化剂催化效率影响情况如图1所示。
。常压下,FeCoMnK/BeO作催化剂,按n(CO2):n(H2)=l:3(总物质的量为4amol)的投料比充入密闭容器中发生反应,测得温度对CO2的平衡转化率和催化剂催化效率影响情况如图1所示。
①250℃下,上述反应达到平衡时容器体积为VL,则此温度下该反应的平衡常数为_____ (用含a、V的代数式表示)。
②若反应开始时,在0.1MPa条件下,以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生上述反应,不同温度下平衡时的四种气态物质的物质的量分数如图2所示。
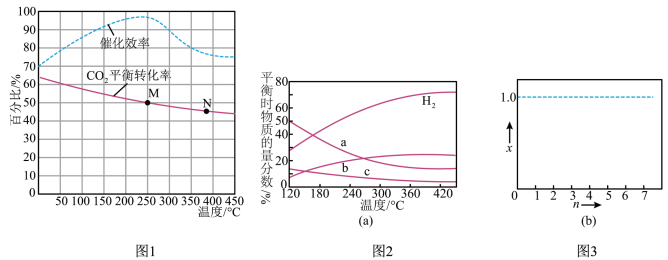
若氢气和二氧化碳的物质的量之比为n:1(n≥3)进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在图3中绘制x随n(n≥3)变化的示意图_____ (标出曲线的起点坐标)。
(1)已知
①已知:H2的标准燃烧热为286kJ·mol-1,H2O(g)=H2O(1) △H3=-44kJ·mol-1,计算△H1=
②已知在一定温度下的发生反应:
(2)利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:

| A.该反应的△H<0,且p1>p2 |
| B.C点时,CO转化率为75% |
| C.A、B、C、D的平衡常数大小关系:A=B>C>D |
| D.若p1时最初充入1molCO,经过5min达到B点的平衡状态,此段时间v(CH3OH)=l.75mol·L-1.min-1 |
①250℃下,上述反应达到平衡时容器体积为VL,则此温度下该反应的平衡常数为
②若反应开始时,在0.1MPa条件下,以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生上述反应,不同温度下平衡时的四种气态物质的物质的量分数如图2所示。

若氢气和二氧化碳的物质的量之比为n:1(n≥3)进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在图3中绘制x随n(n≥3)变化的示意图
甲醇可采用多种方法制备,其用途广泛,是重要的化工原料。
Ⅰ.利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,发生反应如下:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
②CO2(g)+3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(1)反应①过程中能量变化如下图所示,下列说法正确的是______________ (填选项标号)。
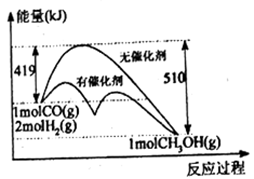
A.①反应的△H=逆反应活化能-正反应活化能
B.把1molCO(g)和2molH2(g)充入密闭容器中充分反应,达平衡时放出的热量为91kJ
C.从图中信息可知加入催化剂能改变反应历程和热效应
D.相同条件下,CO(g)和H2(g)反应生成1mol液态CH3OH放出的热量大于91kJ
(2) 现利用①和②两个反应合成CH3OH, 已知CO可使反应的催化剂寿命下降。
若氢碳比表示为f= [(n(H2)-n(CO2)]/[(n(CO)-n(CO2)],则理论上f=______________ 时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是:______________________________ 。
Ⅱ.甲醇可用于制取甲酸甲酯,其反应方程式为:CH3OH(g)+CO(g) HCOOCH3(g) △H<0。科研人员的部分研究结果如下:
HCOOCH3(g) △H<0。科研人员的部分研究结果如下:

(3)从反应压强对甲醇转化率的影响“效率”图和生产成本角度分析,工业制取甲酸甲酯应选择的最佳压强是______________________ (填“3.5×106 Pa”“4.0×106 Pa”或“5.0×106 Pa”)。
(4)实际工业生产中采用的温度是80℃,其理由是_______________________________________ 。
Ⅲ.甲醇还可以用于合成二甲醚,发生的反应为2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知该反应在某温度下的平衡常数为900,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
(5)比较此时正、逆反应速率的大小: v正___________ v逆 (填“>“<”或“=”)。
(6) 若加入CH3OH后,经6min反应达到平衡,则该时间内平均反应速率v (CH3OH) =___________ mol/ (L·min)。
Ⅰ.利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,发生反应如下:
①CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)②CO2(g)+3H2(g)
 CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)(1)反应①过程中能量变化如下图所示,下列说法正确的是

A.①反应的△H=逆反应活化能-正反应活化能
B.把1molCO(g)和2molH2(g)充入密闭容器中充分反应,达平衡时放出的热量为91kJ
C.从图中信息可知加入催化剂能改变反应历程和热效应
D.相同条件下,CO(g)和H2(g)反应生成1mol液态CH3OH放出的热量大于91kJ
(2) 现利用①和②两个反应合成CH3OH, 已知CO可使反应的催化剂寿命下降。
若氢碳比表示为f= [(n(H2)-n(CO2)]/[(n(CO)-n(CO2)],则理论上f=
Ⅱ.甲醇可用于制取甲酸甲酯,其反应方程式为:CH3OH(g)+CO(g)
 HCOOCH3(g) △H<0。科研人员的部分研究结果如下:
HCOOCH3(g) △H<0。科研人员的部分研究结果如下:
(3)从反应压强对甲醇转化率的影响“效率”图和生产成本角度分析,工业制取甲酸甲酯应选择的最佳压强是
(4)实际工业生产中采用的温度是80℃,其理由是
Ⅲ.甲醇还可以用于合成二甲醚,发生的反应为2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)已知该反应在某温度下的平衡常数为900,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol/L) | 1.25 | 0.9 | 0.9 |
(5)比较此时正、逆反应速率的大小: v正
(6) 若加入CH3OH后,经6min反应达到平衡,则该时间内平均反应速率v (CH3OH) =
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网