解答题-原理综合题 适中0.65 引用4 组卷661
I.氢气是一种清洁能源,水煤气变换反应的制氢原理为:
 ,回答下列问题:
,回答下列问题:
(1)水煤气变换部分基元反应如下:
第②步基元反应逆反应的活化能为___________ eV。
(2)某研究所探究CuO/ 的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:___________ 。
②C/Z-120曲线先上升后下降的原因___________ 。
II.长征运载火箭推进剂为 和
和 。
。
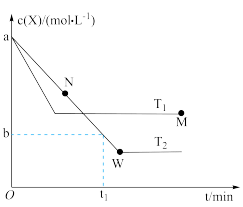
(3)在t℃、pMPa下,将 (g)和物质的量分数为m%的
(g)和物质的量分数为m%的 (g)通入反应器:①
(g)通入反应器:① ,②
,② ,一段时间后
,一段时间后 完全反应,反应②达平衡,
完全反应,反应②达平衡, 与
与 的体积比为1:2,则反应②的平衡常数
的体积比为1:2,则反应②的平衡常数
___________ MPa。
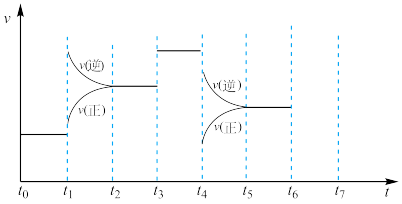
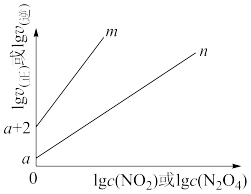
(4)T℃时, ,该反应正、逆反应速率与浓度的关系为:
,该反应正、逆反应速率与浓度的关系为: ,
,
 (
( 、
、 这是速率常数)。
这是速率常数)。
①图中表示 的线是
的线是___________ (填“m”或“n”) 气体,平衡后测得
气体,平衡后测得 为1.0
为1.0 ,则平衡时,
,则平衡时, =
=________ (用含a的表达式表示)。
③T℃时,向2L的容器中充入5mol 气体和1mol
气体和1mol 气体,此时
气体,此时
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)水煤气变换部分基元反应如下:
| 基元反应 | 活化能Ea(eV) | 反应热△H(eV) |
| ① | 0 | -1.73 |
| ② | 0.81 | -0.41 |
(2)某研究所探究CuO/
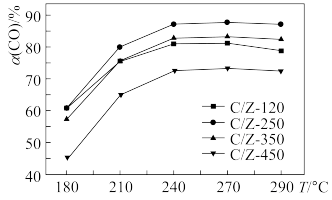
②C/Z-120曲线先上升后下降的原因
II.长征运载火箭推进剂为
(3)在t℃、pMPa下,将
(4)T℃时,
①图中表示
③T℃时,向2L的容器中充入5mol
2022·山东日照·一模
类题推荐
氢气是一种清洁能源,水煤气变换反应的制氢原理为: 。回答下列问题:
。回答下列问题:
(1)氢气用作清洁能源的原因是___________ 。
(2)水煤气变换部分基元反应如下:
第②步基元反应逆反应的活化能为___________ eV。
(3)某研究所探究CuO/ZrO2的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图1:
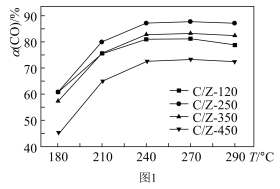
①工业生产中应选择的最佳反应条件为___________ 。
②C/Z-250曲线先上升后基本不变的原因___________ 。
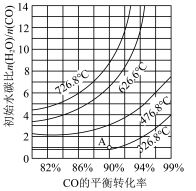
(4)反应的平衡受多种因素影响,如图曲线表示CO平衡转化率与温度和水碳比的关系,则最佳的温度和水碳比是___________ ,图中A点对应的平衡常数为___________ 。
(1)氢气用作清洁能源的原因是
(2)水煤气变换部分基元反应如下:
| 基元反应 | 活化能 | 反应热 |
| ① | 0 | -1.73 |
| ② | 0.81 | -0.41 |
(3)某研究所探究CuO/ZrO2的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图1:

①工业生产中应选择的最佳反应条件为
②C/Z-250曲线先上升后基本不变的原因
(4)反应的平衡受多种因素影响,如图曲线表示CO平衡转化率与温度和水碳比的关系,则最佳的温度和水碳比是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网