解答题-实验探究题 适中0.65 引用1 组卷112
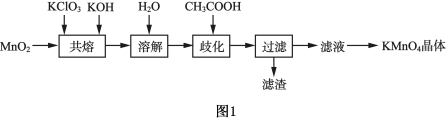
实验室探究制备高锰酸钾的绿色化方案,其实验流程如图1。
已知:K2MnO4水溶液呈墨绿色,在酸性、中性和弱碱性环境下,MnO 会发生自身氧化还原(歧化)反应,生成MnO
会发生自身氧化还原(歧化)反应,生成MnO 和MnO2,部分试剂熔点、分解温度见如表:
和MnO2,部分试剂熔点、分解温度见如表:
(1)在强碱性条件下,MnO2与KClO3共熔可制得K2MnO4,其化学方程式为___________ 。投料的顺序为先加入KOH和KClO3混合均匀,待小火完全熔融,再加入MnO2,迅速搅拌。不能先将KClO3与MnO2混合的原因是___________ 。
(2)溶解后所得溶液转入三颈瓶中,趁热滴入6mol•L﹣1的乙酸,调节pH≈10,在如图2所示的装置中进行歧化。

①该步骤中如果pH控制过高,可能会导致___________ 。
②判断三颈瓶中K2MnO4完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到___________ ,表示MnO 已完全反应。
已完全反应。
(3)从提高原料利用率的角度分析,本实验流程的优点是___________ 。

已知:K2MnO4水溶液呈墨绿色,在酸性、中性和弱碱性环境下,MnO
| 物质 | KOH | KClO3 | MnO2 | K2MnO4 | KMnO4 |
| 熔点/℃ | 406 | 368 | ﹣ | ﹣ | ﹣ |
| 分解温度/℃ | 1323 | >400 | 530 | 190 | 240 |
(2)溶解后所得溶液转入三颈瓶中,趁热滴入6mol•L﹣1的乙酸,调节pH≈10,在如图2所示的装置中进行歧化。

①该步骤中如果pH控制过高,可能会导致
②判断三颈瓶中K2MnO4完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到
(3)从提高原料利用率的角度分析,本实验流程的优点是
21-22高三上·江苏连云港·阶段练习
类题推荐
高锰酸钾(KMnO4)又名灰锰氧,在实验室、化工生产、医疗等领域有广泛的应用。某实验小组利用MnO2为原料,与KClO3和KOH共熔制得锰酸钾,再利用歧化法制备高锰酸钾。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5gKClO3和5.2gKOH倒入铁坩埚中,加热熔融后将3gMnO2分多次加入并搅拌至干涸,继续加热5min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0mol/L醋酸溶液调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
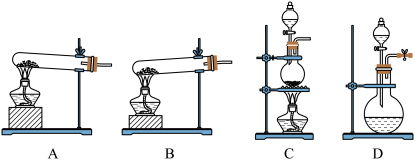
(1)实验室常用高锰酸钾制O2,应选择下列___ (填序号)装置。
(2)①步骤Ⅰ中,墨绿色熔融物为___ (化学式)。
②反应1的化学方程式为___ 。
(3)步骤Ⅱ中控制反应温度的方法是___ 。
(4)本实验采用6.0mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如表:
由表中数据得到结论___ 。
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是___ 。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5gKClO3和5.2gKOH倒入铁坩埚中,加热熔融后将3gMnO2分多次加入并搅拌至干涸,继续加热5min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0mol/L醋酸溶液调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
(1)实验室常用高锰酸钾制O2,应选择下列

(2)①步骤Ⅰ中,墨绿色熔融物为
②反应1的化学方程式为
(3)步骤Ⅱ中控制反应温度的方法是
(4)本实验采用6.0mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如表:
| 实验编号 | pH值 | 产量/g | 平均产率/% |
| 1 | 11.04 | 2.06 | 56.5 |
| 2 | 10.50 | 2.24 | 61.7 |
| 3 | 10.00 | 2.33 | 64.2 |
| 4 | 9.50 | 2.13 | 58.6 |
| 5 | 9.04 | 1.86 | 51.3 |
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是
高锰酸钾(KMnO4)又名灰锰氧,在实验室、化工生产、医疗等领域有广泛的应用。某实验小组利用MnO2为原料,与KClO3和KOH共熔制得锰酸钾,再利用歧化法制备高锰酸钾。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5 g KClO3和5.2 g KOH倒入铁坩埚中,加热熔融后将3 g MnO2分多次加入并搅拌至干涸,继续加热5 min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60 mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0 mol/L醋酸调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
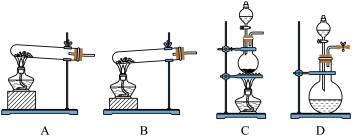
(1)实验室常用高锰酸钾制O2,应选择下列哪套装置___
(2)①步骤Ⅰ中,墨绿色熔融物为___ (化学式)。
②反应1的化学方程式为___ 。
③铁坩埚不能换成瓷坩埚,原因是___ 。
(3)步骤Ⅱ中控制反应温度的方法是___ 。
(4)本实验采用6.0 mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如下表:
由表中数据得到结论____ 。
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2 mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是___ 。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5 g KClO3和5.2 g KOH倒入铁坩埚中,加热熔融后将3 g MnO2分多次加入并搅拌至干涸,继续加热5 min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60 mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0 mol/L醋酸调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
(1)实验室常用高锰酸钾制O2,应选择下列哪套装置

(2)①步骤Ⅰ中,墨绿色熔融物为
②反应1的化学方程式为
③铁坩埚不能换成瓷坩埚,原因是
(3)步骤Ⅱ中控制反应温度的方法是
(4)本实验采用6.0 mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如下表:
| 实验编号 | pH值 | 产量/g | 平均产率/% |
| 1 | 11.04 | 2.06 | 56.5 |
| 2 | 10.50 | 2.24 | 61.7 |
| 3 | 10.00 | 2.33 | 64.2 |
| 4 | 9.50 | 2.13 | 58.6 |
| 5 | 9.04 | 1.86 | 51.3 |
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2 mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是
苯甲酸(C6 H 5COOH)是一种重要的化工原料,广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸的步骤如下:
步骤一:在如图甲所示装置的三颈瓶中加入2.7mL甲苯(2.3g)、100mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动的水,在石棉网上加热至沸腾,然后分批加入8.5g高锰酸钾,在100℃时,继续搅拌约4~5h,再停止反应。
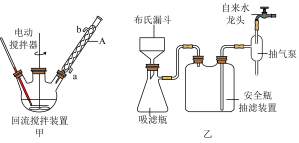
步骤二:将反应后的混合液过滤,滤液用浓盐酸酸化后用图乙所示的装置抽滤得粗产品。
步骤三:将粗产品进行重结晶即得纯品苯甲酸。
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
(1)仪器A的名称为___________ ,其出水口是___________ (填“a”或“b”)。
(2)步骤一中,应在三颈瓶中观察到_________________________________ 的现象时才停正反应。
(3)反应结束时,测得三颈瓶中混合液为碱性,则三颈瓶内发生反应的化学方程式为_________________________________ (在本实验条件下,高锰酸钾的还原产物是MnO2)
(4)步骤二中抽滤的优点是____________________________________________ 。
(5)如图乙所示抽滤完毕时,应先断开______________________ 之间的橡皮管。
(6)步骤二中,如果滤液呈紫色,要先加KHSO3,原因是______________________ 。
(7)若提纯得到2.9g苯甲酸,则甲酸的产率是___________ %。(保留到小数点后一位)
步骤一:在如图甲所示装置的三颈瓶中加入2.7mL甲苯(2.3g)、100mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动的水,在石棉网上加热至沸腾,然后分批加入8.5g高锰酸钾,在100℃时,继续搅拌约4~5h,再停止反应。
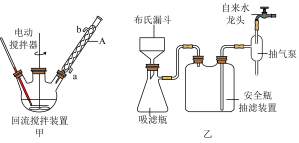
步骤二:将反应后的混合液过滤,滤液用浓盐酸酸化后用图乙所示的装置抽滤得粗产品。
步骤三:将粗产品进行重结晶即得纯品苯甲酸。
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 | 易溶 | ||
| 苯甲酸 | 122.4(100℃左右升华) | 248 | 1.2659 | 微溶 |
(2)步骤一中,应在三颈瓶中观察到
(3)反应结束时,测得三颈瓶中混合液为碱性,则三颈瓶内发生反应的化学方程式为
(4)步骤二中抽滤的优点是
(5)如图乙所示抽滤完毕时,应先断开
(6)步骤二中,如果滤液呈紫色,要先加KHSO3,原因是
(7)若提纯得到2.9g苯甲酸,则甲酸的产率是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


