解答题-原理综合题 适中0.65 引用4 组卷283
利用温室气体CO2作为温和氧化剂选择性氧化乙烷制乙烯,对资源综合利用有重要意义,CO2氧化乙烷制乙烯的反反应可表示为反应 H2O(g) △H1
H2O(g) △H1
研究表明,在催化剂作用下,反应I实际分两步进行,相关化学反应如下:
II:C2H6(g)⇌C2H4(g)+H2(g) △H2
III:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3
回答下列问题:
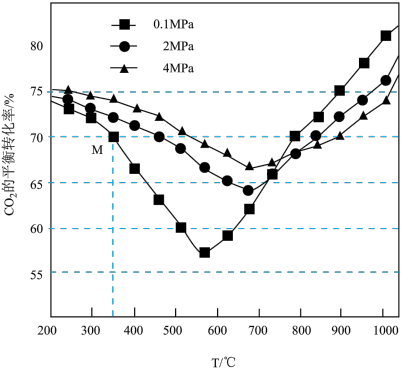
(1)反应I、II、III的平衡常数K与温度变化关系如图所示。

据图判断1molC2H4和1molH2的总能量___________ 1molC2H6的能量(填“>”“=”或“<”,下同);反应I和反应III的焓变大小关系为△H1___________ △H3
(2)在1L密闭容器甲中充入1molC2H6和1molCO2,在催化剂作用下主要发生反应II、反应III及副反应IV:C2H6(g)+2CO2(g)⇌4CO(g)+3H2(g)。10min后,各反应均达到平衡状态,乙烷的平衡转化率(α)及乙烯选择性与温度的关系如图所示(选择性是指生成目的产物所消耗的C2H6与反应中C2H6总消耗量的物质的量比)。
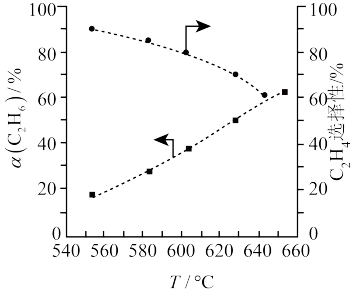
①副反应IV不利于乙烯生成的原因为_____ ,要提高CO2的转化率,可采取的措施是____ 。
②已知某温度时乙烯选择性为70%,容器中H2O的物质的量为0.1mol。则此时C2H6的浓度c(C2H6)=_____ mol·L-1,C2H4和H2的物质的量之比为_____ 。
③以CO2表示的反应速率为v(CO2)=____ mol/(L·min),反应III的平衡常数K=____ 。
研究表明,在催化剂作用下,反应I实际分两步进行,相关化学反应如下:
II:C2H6(g)⇌C2H4(g)+H2(g) △H2
III:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3
回答下列问题:
(1)反应I、II、III的平衡常数K与温度变化关系如图所示。

据图判断1molC2H4和1molH2的总能量
(2)在1L密闭容器甲中充入1molC2H6和1molCO2,在催化剂作用下主要发生反应II、反应III及副反应IV:C2H6(g)+2CO2(g)⇌4CO(g)+3H2(g)。10min后,各反应均达到平衡状态,乙烷的平衡转化率(α)及乙烯选择性与温度的关系如图所示(选择性是指生成目的产物所消耗的C2H6与反应中C2H6总消耗量的物质的量比)。

①副反应IV不利于乙烯生成的原因为
②已知某温度时乙烯选择性为70%,容器中H2O的物质的量为0.1mol。则此时C2H6的浓度c(C2H6)=
③以CO2表示的反应速率为v(CO2)=
21-22高三下·湖南·开学考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网